- 후각수용체의 활성/비활성 구조 규명을 통해 냄새물질 인지의 분자적 메커니즘 규명 -
[연구필요성]
후각수용체는 인체 내에서 냄새를 인지하는데 중요한 기능을 하는 세포막 단백질로, 외부의 냄새물질(odorant)과 결합하여 후각 신경세포의 탈분극을 일으킨다. 사람의 경우 약 400 종의 후각수용체가 존재하는데, 현재까지는 이 중 단 하나의 후각수용체의 활성 상태 구조만이 밝혀져 있다. 특히, 비활성 상태의 후각수용체 구조는 알려진 바 없어 냄새물질의 결합 과정 및 냄새 인지의 분자적 메커니즘에 대한 이해는 매우 부족한 상황이다. 본 연구에서는 후각수용체 OR52 패밀리의 활성 및 비활성 상태 구조를 최초로 밝힘으로써, 후각수용체의 냄새물질 인식과 이에 따른 활성화 기작에 대한 이해를 높이고자 하였다.
[연구성과/기대효과]
본 연구팀은 후각수용체 OR52 패밀리를 대표하는 아미노산 서열을 가진 OR52 consensus (OR52cs) 수용체에 후각물질과 G 단백질이 결합한 활성상태의 구조를 규명하였으며, 더불어 아무런 후각물질이 결합하지 않은 비활성 상태의 후각수용체 구조를 최초로 밝혔다. 구조 데이터 분석과 이를 뒷받침하는 여러 세포 실험 및 분자 동역학 시뮬레이션 결과를 통해 후각물질이 후각수용체에 어떻게 특이적으로 결합하는지, 그리고 후각물질 결합에 의해 후각수용체가 어떠한 구조 변화를 나타내는지 그 분자적 메커니즘을 최초로 규명하였다.
이러한 후각수용체의 구조적 정보 및 작용기전은 향수 및 식품 개발에 활용될 수 있을 것이며 위험 물질 감지 및 전자 코 개발등의 다양한 산업분야에서의 활용도 기대할 수 있다.
[연구배경]
냄새를 인지하는 후각시스템은 미각과 함께 음식물을 인식하는데 관여할 뿐 아니라 연기와 같은 외부 위험신호를 감지하는데에도 중요하게 작용한다. 또한, 특정 냄새는 정서적 기억을 촉발시키기도 한다. 이러한 후각시스템에서 특정 냄새물질을 인식하고 하위신호전달에 관여하는 단백질이 후각수용체이다. 후각수용체는 G-단백질 결합 수용체(GPCR) 패밀리에 속하는 세포막 단백질로, 인간의 경우 약 400종의 후각수용체가 존재함이 알려져 있으며 이들은 후각 상피세포의 세포막에 위치한다. 후각수용체는 2004년 노벨생리의학상을 수상한 Linda Buck 교수와 Richard Axel 교수에 의해 1991년 처음 보고되었는데, 30여년이 지난 지금까지도 이들 후각수용체의 작용 메커니즘 및 후각물질 결합 기전에 대해서는 거의 알려진 바가 없다. 서울대학교 생명과학부 최희정 교수 연구팀은 극저온 전자 현미경 기술을 이용하여 후각수용체 OR52cs의 활성 및 비활성 상태 구조를 규명하여 후각수용체 OR52 패밀리의 활성화 메커니즘을 최초로 제시하였다.
[연구내용]
본 연구에서는 후각수용체 OR52cs에 냄새물질(octanoate)과 세포 내 G-단백질까지 결합한 활성상태 후각수용체 복합체의 구조를 극저온전자현미경(Cryo-EM)을 통해 규명함으로써, 후각수용체가 어떻게 특정 냄새물질을 인식하는지에 대한 작용 기전을 분자수준에서 제시하였다. 또한, 냄새물질이 결합하지 않은 즉, 후각수용체가 후각물질에 의해 활성화 되기 이전의 비활성 상태의 후각수용체 구조도 극저온전자현미경을 통해 최초로 규명하였다. 흥미롭게도 비활성 상태의 후각수용체 구조는 지금껏 보고되지 않은 새로운 형태의 GPCR 구조로 막횡단 헬릭스 (TM helix) 5번과 6번 사이가 크게 벌어져 있었다. 이에 본 연구진은 분자 동역학 시뮬레이션 (MD simulations) 및 세포기반 실험 결과를 통해 TM5-TM6 사이의 벌어진 틈을 통해 냄새물질이 후각수용체에 결합하고 냄새물질이 결합하면 후각수용체의 구조변화를 통해 벌어졌던 틈이 닫힌다는 후각수용체의 활성화 메커니즘을 제시하였다. 즉, 후각수용체의 TM6가 마치 게이트로 작용하여 냄새물질이 결합하지 않은 상태에서는 세포 바깥쪽 냄새물질 결합부위가 열려있고 대신 세포 안쪽의 G-단백질 결합부위는 닫혀 있다가, 냄새물질이 결합하게 되면 냄새물질 결합부위는 닫히고 G-단백질 결합부위는 열려서 세포내 G-단백질이 결합하게 된다는 것이다. 이러한 활성화 메커니즘은 아직까지 보고된 바가 없는 새로운 형태의 GPCR 활성화 메커니즘으로 후각수용체만의 독특한 작용 기전으로 보인다.
서울대학교 생명과학부 최희정 교수 연구진이 발표한 이번 연구는 삼성미래기술육성사업의 지원으로 수행되었으며 연구결과는 네이처 커뮤니케이션즈(Nature Communications) 저널에 12월 7일자로 게재되었다.
[연구결과]
Understanding the molecular mechanisms of odorant binding and activation of the human OR52 family
(Nature Communications, 07 December 2023, https://www.nature.com/articles/s41467-023-43983-9)
Chulwon Choi, Jungnam Bae, Seonghan Kim, Seho Lee, Hyunook Kang, Jinuk Kim, Injin Bang, Kiheon Kim, Won-Ki Huh, Chaok Seok, Hahnbeom Park, Wonpil Im, Hee-Jung Choi
후각수용체는 G-단백질 결합 수용체(GPCR) 패밀리에 속하는 세포막 단백질이며, 이들 GPCR의 구조 연구는 2012년 Kobilka 교수와 Lefkowitz 교수의 노벨화학상 수상이후 활발히 진행되고 있다. 그러나, GPCR 패밀리의 절반에 해당하는 후각수용체의 경우, 발현과 정제의 어려움으로 인하여 구조 및 분자수준에서의 메커니즘 연구는 그 중요성에도 불구하고 거의 이루어지지 못하고 있는 실정이다. 올해 초, 후각수용체 OR51E2와 냄새물질 propionate의 결합 구조가 유일하게 보고되었지만 (Nature, 2023), 후각물질이 결합하기 전 상태의 비활성 상태 후각수용체 구조는 전혀 밝혀진 바가 없어 냄새물질이 후각수용체에 결합하는 과정에 대한 이해는 매우 제한적이었다. 본 연구에서는 후각수용체 OR52 패밀리를 대표하는 OR52 consensus (OR52cs)를 이용하여 냄새 물질이 결합한 활성상태 뿐 아니라 아무런 리간드가 결합하지 않은 비활성 상태의 후각수용체 구조를 최초로 규명하였다. 비활성 상태 구조에서는 막횡단 헬릭스 (TM helix) 5번과 6번 사이가 크게 벌어져 있었는데, 이는 기존에 보고된 다른 GPCR 구조에서는 볼수 없었던 특이한 형태이며, 구조 분석 및 분자 동역학 시뮬레이션을 통해 이 부분을 통한 냄새물질 결합 기전을 제안하였다. 또한, 비활성 및 활성 상태 구조를 비교 분석함으로써, 후각수용체만의 특이한 활성화 메커니즘을 최초로 제안하였다.
- ○후각수용체 (Odorant receptor): 후각수용체는 주로 후각 상피세포에 존재하며 냄새물질과 특이적인 결합을 통해 하위신호전달을 야기하는 세포막 단백질이다.
- ○G-단백질 결합 수용체(GPCR): 세포내 G 단백질을 통해 신호전달을 일으키는 세포막 단백질로, 인간의 경우 약 400종의 후각수용체를 포함하여 총 800종의 GPCR 단백질을 가지고 있다. 현재 시판되는 약의 30-40%가 GPCR을 표적으로 하고 있어 신약 개발을 위한 구조 연구도 활발히 진행되고 있다.
- ○극저온 전자현미경 (Cryo-EM): 세포 내 고분자 물질, 즉 단백질 및 핵산 구조 규명에 이용되는 장비로서, 약 –200℃의 온도에서 시료를 급속 동결하여 자연 상태의 단백질 구조를 관찰할 수 있는 기술이다. 특히, 막단백질 및 고분자 단백질 복합체의 구조 규명에 널리 활용되고 있으며, 구조 규명에 대한 유용성이 인정되어 2017년에 노벨 화학상을 받은 분야이다.
[그림설명]
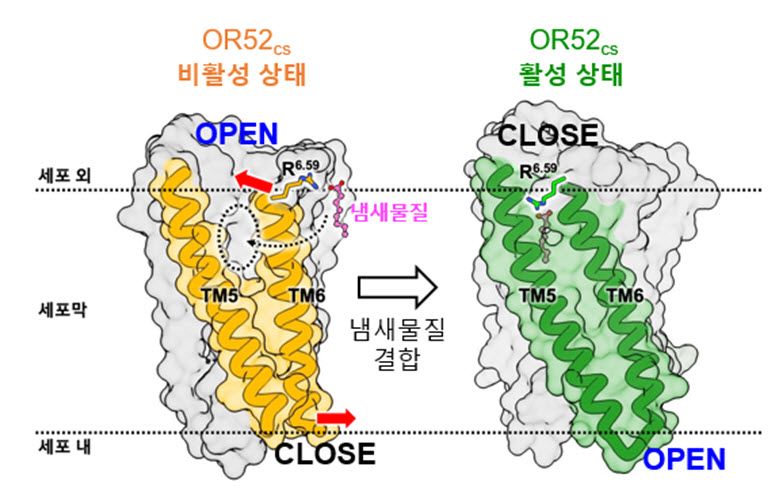
- 본 연구에서는 후각수용체 OR52cs가 냄새물질과 결합하기 전의 비활성 상태 구조(왼쪽)와, 냄새물질 및 G 단백질과 결합한 활성 상태 구조(오른쪽)를 최초로 규명하였다.
- 이들 구조의 비교 분석을 통해 OR52 패밀리 후각수용체의 활성화 메커니즘 및 냄새물질 인지 기전을 제시하였다.

