세포골격 리모델링에 의한 노화 세포의 비대증,
노화연관 염증인자의 전사 조절 촉진
[연구필요성]
우리의 세포는 다양한 스트레스에 반응하여 추가 증식 및 종양 형성을 억제하는 내재적 기전인 세포 노화 현상을 보인다. 이러한 노화 세포는 신체 내 과도하게 축적될 경우 노화연관 염증 반응을 통해-마치 영화 속 좀비와 같이-주변 세포 및 조직에 악영향을 끼치고, 여러 노화연관 질환 및 개체의 노화를 유도함이 잘 알려져 있다. 노화 세포의 흥미로운 특징 중 하나는 세포 크기가 정상 세포에 비해 뚜렷하게 커진다는 점이다. 노화 세포의 비대증은 세포 노화가 처음 보고된 1960년대부터 잘 알려졌지만, 긴 세월 동안 별다른 기능을 수행하지 않는 것으로 여겨졌다. 이에 대한 연구는 노화 세포의 오랜 미스터리를 풀고 세포 노화 현상에 대한 이해를 증진함으로써, 노화 세포 표적 기술을 고도화하고 초고령화 사회에 대한 과학적 대책 마련에 이바지할 수 있기에 중요하다.
[연구성과/기대효과]
개체 노화의 주요 원인인 노화 세포는 정상 세포에 비해 세포의 크기가 뚜렷하게(약 2-10배) 증가하는 것이 잘 알려져 있다. 이러한 노화 세포 비대증이 어떻게 조절되는지, 세포 노화에서 어떤 기능을 하는지 알려진 바가 없었다. 서울대학교 생명과학부 강찬희 교수 연구진은 노화 세포가 비대해지는 동안 세포골격의 리모델링이 활발하게 일어나며, 해당 변화는 노화 세포 비대증뿐 아니라 노화연관 염증인자의 발현에도 필요함을 확인하였다. 노화 세포의 세포골격 리모델링은 전사인자 GATA4와 물리적 자극센서 YAP의 경쟁에 따른 세포골격 조절인자의 발현 변화에 기인한다. 세포 노화 비대증을 약물 또는 유전자 조절을 통해 억제 시, 흥미롭게도 노화 세포는 노화연관 염증인자를 발현하지 못하였다. 강찬희 교수 연구진은 노화 세포가 커지면서 핵공이 변화하고, 노화연관 분비표현형의 조절인자인 GATA4와 NF-kB의 핵 내 유입을 용이하게 하여 노화연관 염증인자의 발현을 증가시킬 수 있음을 새롭게 확인하였다. 특히 이러한 변화가 지방 조직의 노화 과정에서 활발하게 일어나고 있음을 검증하였다. 본 연구는 오랜 기간 동안 미스터리로 남아 있던 노화 세포의 비대증 조절 및 작용 기전을 최초로 규명하였다는 점에서 큰 과학적 의의가 있을 뿐만 아니라, 노화 비대증 제어를 통해 노화연관 염증 반응을 억제할 수 있다는 점에서 신규 노화 치료 전략을 제시하였다.
[본문]
우리의 세포는 다양한 스트레스에 반응하여 추가 증식 및 종양 형성을 억제하는 내재적 기전인 세포 노화 현상을 보인다. 이러한 노화 세포는 신체 내 과도하게 축적될 경우 노화연관 염증 반응을 통해 주변 세포 및 조직에 악영향을 끼치고, 여러 노화연관 질환 및 개체의 노화를 유도함이 잘 알려져 있다-마치 영화 속 좀비처럼 말이다. 노화 세포의 흥미로운 특징 중 하나는 세포의 크기가 정상 세포에 비해 뚜렷하게(약 2-10배) 증가한다는 점이다. 노화 세포 비대증은 세포 노화가 처음 보고된 1960년대부터 잘 알려졌지만, 긴 세월 동안 별다른 기능을 수행하지 않는 것으로 여겨졌다. 최근 국내 연구진이 노화 세포 비대증 조절 기전을 새롭게 밝혀내고, 긴 세월 동안 수수께끼로 남아 있던 노화 세포 비대증의 기능에 대한 중요한 실마리를 제공하였다. 서울대학교 생명과학부 강찬희 교수 연구진은 지난 2월 세포골격의 리모델링이 노화 세포 비대증과 노화연관 염증인자의 발현에 필요하다는 것을 규명했다고 밝혔다.
개체 노화의 주요 원인으로 작용하는 노화 세포는 정상 세포에 비해 세포의 크기가 매우 크다는 것이 오랜 기간 동안 잘 알려져 있다. 하지만 이러한 노화 세포 비대증이 어떻게 조절되는지, 그리고 세포 노화 반응에 어떤 기여를 하는지는 알려진 바가 없었다. 연구진은 이 수수께끼를 풀기 위해 노화 세포가 비대해지는 동안 세포골격의 리모델링이 활발하게 일어남에 주목하였다. 연구진은 세포골격의 리모델링을 억제하였을 때, 흥미롭게도 노화 세포가 더 이상 염증인자의 발현을 촉진하지 못함을 발견하였다. 연구진은 다양한 유전학 실험을 통해, 노화 세포 특이적 세포골격 리모델링이 전사인자 GATA4와 물리적 자극센서 YAP의 경쟁에 따른 세포골격 조절인자 RHOU의 발현 조절에 기인함을 규명하였다. 노화 세포 비대증은 세포골격 리모델링을 통해 전사인자가 핵 내로 드나들 수 있는 통로인 핵공의 변화를 유도하여, 노화연관 분비표현형의 조절인자인 GATA4와 NF-kB의 핵 내 유입을 용이하게 하고 염증인자의 발현을 증가시킬 수 있음을 새롭게 확인하였다. 연구진은 특히 이러한 변화가 자연 노화 및 고지방식이 유도 노화 쥐 모델에서 활발하게 일어남을 확인하였을 뿐만 아니라, 대규모 데이터 분석을 통해 인간의 노화 과정에서도 보존되어 있음을 검증하였다.
강찬희 교수는“본 연구는 오랜 기간 동안 미스터리로 남아 있던 노화 세포의 비대증 조절 및 작용 기전을 최초로 규명하였다는 점에서 큰 과학적 의의가 있다”고 밝혔다. 연구의 공동 교신 저자인 김미성 연구교수(시스템스 노화기전 연구센터, 센터장: 정종경 교수)는“노화 비대증 제어를 통해 노화연관 염증 반응을 억제할 수 있다는 점에서 신규 노화 치료 전략을 제시한 연구”라며“해당 제어법은 노화의 기본 단위인 세포 노화를 표적으로 삼기에, 대사 질환뿐만 아니라 다양한 노화연관 질환에도 적용 가능성이 크다”라고 말했다.
서울대학교 생명과학부 강찬희 교수 연구진이 수행한 이번 연구는 서경배과학재단, 한국연구재단, 산업기술알키미스트프로젝트의 지원을 받았으며, 유수 과학 권위지 ‘네이처 커뮤니케이션즈(Nature Communications“에 지난 2월 공개됐다.
[연구결과]
Cell enlargement modulated by GATA4 and YAP instructs the senescence-associated secretory phenotype
Joae Joung, Yekang Heo, Yeonju Kim, Jaejin Kim, Haebeen Choi, Taerang Jeon, Yeji Jang, Eun-Jung Kim, Sang Heon Lee, Jae Myoung Suh, Stephen J. Elledge, Mi-Sung Kim & Chanhee Kang
(Nature Communications, https://www.nature.com/articles/s41467-025-56929-0)
세포 크기의 역동적 변화는 개체의 정상 발달뿐만 아니라 노화를 포함한 병리적 상황과 연관되어 있다. 여러 노화연관 질환 및 개체 노화의 주요 원인인 노화 세포의 흥미로운 특징 중 하나는 세포의 크기가 정상 세포에 비해 뚜렷하게 커진다는 점이다. 이러한 노화 세포 비대증은 세포 노화가 처음 보고된 1960년대부터 잘 알려졌으나, 조절 기전 및 기능에 대해서는 알려진 바가 없었다. 본 연구진은 세포골격의 리모델링이 노화 세포 비대증뿐만 아니라 노화연관 염증인자의 발현에도 중요하게 기여한다는 것을 새롭게 확인하였다. 노화 세포의 세포골격 리모델링은 노화연관 분비표현형의 조절인자 GATA4와 물리적 자극센서 YAP의 경쟁에 따른 세포골격 조절인자 RHOU의 발현 조절에 기인하였다. 본 연구진은 노화 세포 비대증을 약물 또는 유전학적 방법으로 억제하였을 때, 노화 세포가 더 이상 염증인자의 발현을 촉진하지 못함을 발견하였다. 노화 세포 비대증은 세포골격 리모델링을 통해 전사인자가 핵으로 드나들 수 있는 통로인 핵공의 변화를 유도하여, 노화연관 분비표현형 조절인자인 GATA4와 NF-kB의 핵 내 유입을 용이하게 하고 염증인자의 발현을 증가시켰다. 이러한 변화는 자연 노화 및 고지방식이 유도 노화 쥐 모델의 지방 조직에서 활발하게 일어나고 있었으며, 대규모 데이터 분석에 따르면 인간의 노화 과정에서도 보존되어 있음을 확인하였다. 본 연구는 오랜 기간 동안 수수께끼로 남아 있던 노화 세포의 비대증의 조절 기전을 밝혔을 뿐만 아니라, 놀랍게도 노화연관 염증 반응에 기여할 수 있음을 규명함으로써 세포 노화 조절 네트워크의 물리적 조절 경로를 최초로 보고했다는 의의가 있다. 해당 경로의 조절은 새로운 노화 세포 표적 기술 개발에 실마리를 제공한다는 점에서 중요하다.
- ○세포 노화(Cellular senescence): 다양한 스트레스(예) 텔로미어 손실, DNA 손상 반응, 활성 산소 스트레스, 종양 유도 스트레스)에 의해 정상 세포가 분열을 비가역적으로 멈추고 다양한 염증 유발 인자를 분비하는 현상을 말한다. 노화 세포의 축적은 주변 정상 세포 및 조직의 기능을 저하하고, 개체 노화 및 다양한 노화 연관 질환을 유발한다. 최근 노화 세포를 제어함으로써 노화를 억제할 수 있다는 것이 보고되면서, 세포 노화는 현재 노화 치료제 개발의 표적으로 크게 부각되고 있다.
- ○세포골격(Actin cytoskeleton) : 액틴 필라멘트(Actin filaments)와 단백질의 네트워크로 세포의 모양, 구조, 그리고 움직임을 지지하는 데 중요한 역할을 한다.
- ○핵공(Nuclear pore complex) : 핵(Nucleus)과 세포질(Cytoplasm) 상의 물질 교환을 담당하는 통로로 거대 단백질 복합체로 구성되어 있다.
[그림설명]
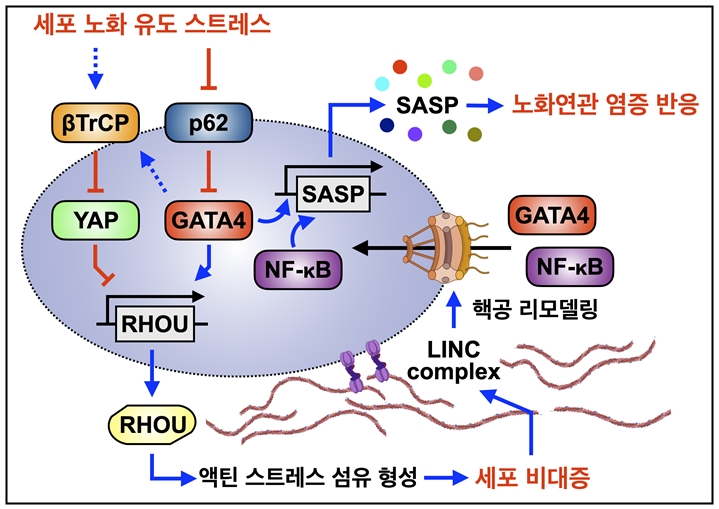
GATA4와 YAP 경쟁에 의해 조절되는 노화 세포 비대증과 노화연관 염증 반응: 세포 노화 반응 시 노화연관 분비표현형(SASP)의 조절인자 GATA4와 물리적 자극센서 YAP의 경쟁에 따라 세포골격 조절인자 RHOU의 발현이 증가한다. 이는 액틴 스트레스 섬유 형성을 촉진하고, 노화 세포 비대증을 유도한다. 궁극적으로 이러한 변화는 핵공의 리모델링을 유도하여, 노화연관 분비표현형 주 조절인자인 GATA4와 NF-kB의 핵 내 유입을 증가시켜 노화연관 염증 인자의 발현을 촉진하고 노화 및 노화연관 질환의 원인으로 작용한다.

