- TM4SF5와 SLAMF7 결합을 억제하는 isoxazole 기반 약물을 통한 자연살상세포의 세포독성 회복 및 간암 억제 -
[연구필요성]
한국인의 간암 발병률 높고 5년 생존률은 39%로 여전히 낮음. 하지만 간암의 효과적인 치료제가 없음.
요즘 개발되어 처방되고 있는 면역관문(Immune checkpoint) 억제제의 경우 간암 치료 효능에 한계가 확인되고 있음: 병행처리의 방법적 효과 추구 추세임.
간암세포에서 많이 발현하고 면역 반응을 조절하는 것으로 보고된 TM4SF5 단백질의 억제를 통해 간암 치료의 효과가 증대될 수 있으리라 예상함.
[연구성과/기대효과]
간암 조직에서 간 상피세포에 많이 발현하는 TM4SF5 단백질이 면역 세포의 여러 면역관문 (immune checkpoint)의 발현에 영향을 줌을 알아냄.
특히, TM4SF5는 자연살상세포(Natural Killer cells)의 활성화 관문 SLAMF7의 발현을 낮춤. SLAMF7의 발현 저하는 자연살상세포의 세포 독성을 떨어뜨려 간암이 성장을 억제할 수 없게 됨.
TM4SF5는 원형질막과 리소좀막에 모두 발현·위치하는데, 원형질막에서 SLAMF7과 결합한 후 리소좀으로 SLAMF7를 이동시켜 리소좀에서의 autophagy를 유도하고 분해함 → 세포 원형질막의 SLAMF7 발현량을 줄임 → 암세포와 자연살상세포의 원형질막에 각각 존재하는 SLAMF7의 동종결합이 형성되지 않아 자연살상세포가 암세포를 효율적으로 제거 가능한 활성화의 과정이 억제됨.
TM4SF5 특이적인 억제제 개발함. (TM4SF5-specific isoxazole-based small molecules, TSIs) TSI는 TM4SF5와 SLAMF7의 결합을 억제하여 SLAMF7의 리소좀으로의 이동 및 autophagy를 통한 분해를 막아 자연살상세포의 세포 독성을 유지하게 만듦.
TSI는 면역관문억제제로 이용 가능한 새로운 세대의 항암제 가능성 확인. 이는 간암 치료의 새로운 메커니즘과 타겟을 보여주었고, 추가적 면역항암제 신약 개발의 가능성을 제시함.
[본문]
□ 간암조직에서 TM4SF5 발현 및 SLAMF7와의 연관성 밝힘.
본 연구팀은 in vitro 간암세포주 및 in vivo 생쥐 간암 모델을 이용해 간암 샘플에서 TM4SF5 과다 발현 현상을 관찰함.
또한 TM4SF5 발현이 높은 세포나 조직에서 자연살상세포의 면역관문 중 하나인 SLAMF7의 발현이 낮음을 확인함.
공공데이터 TCGA(The Cancer Genome Atlas) 데이터베이스 가운데 간암 환자에서, TM4SF5와 SLAMF7의 상관성을 밝힘. TM4SF5가 높게 발현하는 환자 가운데 SLAMF7을 낮게 발현하는 환자군이 SLAMF7를 높게 발현하는 환자군에 비해 현저하게 생존율이 떨어짐.
□ TM4SF5에 의한 SLAMF7의 발현 감소의 분자적 메커니즘 규명.
본 연구팀은 TM4SF5의 높은 발현이 SLAMF7 단백질의 분해 과정을 촉진할 것이라 예상하고 프로테아좀 및 오토파지 억제제를 활용. 그 결과 TM4SF5의 발현이 높은 경우, 오토파지를 통해 SLAMF7 단백질 분해가 촉진됨을 밝힘.
TM4SF5를 발현하는 간암세포에서 SLAMF7의 원형질막 위치가 감소하고 리소좀으로의 위치가 증가하고, 리소좀에서의 오토파지를 통한 SLAMF7 단백질 감소로 이어짐.
TM4SF5와 SLAMF7의 N-결합 글리코실화(결합당화)에 의존적으로 두 단백질의 결합이 가능하고, 이로 인해 리소좀으로 이동함을 확인.
TM4SF5-특이적 이소옥사졸 억제제 (TSIs)는 두 단백질의 결합을 억제할 수 있음으로써, TM4SF5가 발현하는 암세포에서도 SLAMF7의 분해를 억제할 수 있어, 자연살상세포의 암세포 살상의 효능을 가지게 할 수 있음을 확인
□ 간암세포의 성장 억제를 위한 TM4SF5 특이적 억제제 개발, 간암 치료의 가능성 시사.
TM4SF5에 특이적으로 작용하는 억제제 (TM4SF5-specific isoxazole-based small molecules, TSIs) 구조 모델링을 통해 TM4SF5와 TSI의 특이적인 결합 및 결합 친화력을 확인.
TSI의 간암 억제 효능: 발암 물질 처리를 통한 간암 모델, 이종이식 또는 환자유래 암조직 이종이식기술을 이용한 간암 모델들에서 TSI의 효능을 관찰한 결과, 간암의 성장이 효율적으로 억제됨을 확인.
TSI를 처리한 동물 간암 조직에서 SLAMF7의 증가 및 확대 분포되는 양상을 확인함.
이러한 연구 성과를 통해 간암조직에서 상피세포와 자연살상세포의 상호작용에 대한 새로운 면역관문억제의 메커니즘을 제시하였고, 새로운 패러다임의 면역항암 치료제의 단서를 확보함.
[연구결과]
Isoxazole-based molecules restore NK cell immune surveillance in hepatocarcinogenesis by targeting TM4SF5 and SLAMF7 linkage
Ji Eon Kim, Hyun Su Kim, Wonsik Kim, Eun Hae Lee, Soyeon Kim, Taewoo Kim, Eun-Ae Shin, Kyung-hee Pho, Haesong Lee, Seo Hee Jin, Jae-Ho Lee, Soo-Min Byeon, Dong Joo Kim, Jinwook Jeoung, Jeoungwon Lee, Minjae Ohn, Hyojung Lee, Su Jong Yu, Dongyun Shin, Semi Kim, Jun Yeob Yoo, Seung-Chul Lee, Young-Ger Suh, and Jung Weon Lee
(Signal Transduction and Targeted Therapy, https://www.nature.com/articles/s41392-024-02106-6)
최근 면역관문 억제를 통한 항암제가 많이 개발되고 있으나, 혈액암과 달리, 고정암인 간암에 대해 효과적인 치료는 아직 이뤄지지 않고 있음. 선천 면역체계 가운데 암세포를 죽인다고 알려진 자연살상세포는 간 조직에 많이 발견됨. 선행 연구에서 본 연구팀은 TM4SF5 단백질이 많이 발현하는 간암 조직을 분석한 결과, 자연살상세포의 기능이 떨어져 있음을 밝힘.
후속 연구로 본 연구에서는 간암 조직의 간 상피세포에 발현하는 TM4SF5에 의해 자연살상세포의 세포독성이 떨어지는 분자적인 메커니즘을 밝히고, 이를 타겟팅하는 새로운 치료제를 개발하고자 하였음. 자연살상세포의 원형질막에 존재하는 자연살상세포의 여러 면역관문을 분석한 결과, TM4SF5 과발현 세포 및 조직에서 활성화 관문인 SLAMF7의 발현이 감소하는 경향을 확인. TM4SF5는 원형질막에 위치하는 SLAMF7과 결합하여 리소좀으로 이동, 리소좀에서의 오토파지를 통해 SLAMF7의 분해를 촉진함. SLAMF7은 간암 세포 및 자연살상세포의 원형질막에 위치하여 동종 상호작용을 통해 자연살상세포가 간암 세포를 제거하도록 하는데, TM4SF5에 의해 이 과정이 억제되어 자연살상세포의 암세포를 죽이는 세포독성(기능)이 떨어지는 결과를 보임. TM4SF5와 SLAMF7의 결합을 억제하는 새로운 화합물을 합성하여 TM4SF5-특이적인 이소옥사졸 억제제 (TM4SF5-specific isoxazole-based small molecules, TSIs)로 TM4SF5-SLAMF7 축의 기능 억제를 통한 항암 효능을 검증함. 발암 물질 처리를 통한 간암 모델, 이종이식 또는 환자유래 암조직 이종이식기술을 이용한 여러 간암 모델 등의 여러 생쥐 간암 모델을 수립하여 TSI의 간암 억제 효능을 관찰함.
본 연구는 간암 세포와 자연살상세포의 상호작용 및 타겟을 새롭게 밝히고, 이로 인한 면역 기능 변화를 알아냄. 또한 효율적 간암 치료를 위한 새로운 패러다임의 면역관문 억제제 약물 개발 가능성을 제시함.
본 연구결과는 2025년 1월 네이처(Nature) 誌를 발행하는 네이처 포트폴리오(Nature Portfolio) 출판사의 생화학분자생물학(313개 저널 중 3위 랭크) 및 세포생물학 (5/205) 분야 최고 국제학술지인 ‘신호 전달 및 표적 치료[Signal Transduction and Targeted Therapy (Impact factor, 40.8, 2023 JCR)]에 온라인으로 게재되었으며, 과학기술정보통신부의 한국연구재단이 지원한 바이오·의료기술개발사업 (차세대바이오/면역기전제어기술개발) 및 (유형2) 중견연구의 지원을 받아 수행된 것임.
- ○TM4SF5 (Transmembrane 4 L six family member 5): 세포막을 네 번 통과하는 막단백질 그룹 중 하나. 정상적 간상피세포에서 다소 발현하지만, 과다 염증의 상황에서는 발현이 과하게 높아져 여러 지방간, 지방간염, 간섬유화 및 간암 등의 간질환이 유발될 수 있음이 확인되었음.
- ○자연살상세포 (Natural killer cells): 선천 면역체계 중 하나로, 암 세포 및 바이러스에 감염된 세포를 제거하는 역할을 함.
- ○면역 관문 (Immune checkpoint): 면역 체계의 조절자로, 면역 체계가 무차별적으로 세포를 공격하는 것을 방지함. 면역 세포의 세포막에 존재하는 수용체가 다른 세포의 면역관문을 인식하여 면역 기능을 촉진 또는 억제함.
- ○세포 독성 (Cytotoxicity): 세포에 대한 독성. 면역 세포가 다른 세포를 죽이는 독성.
- ○SLAMF7 (Signaling lymphocytic activation molecule family member 7): T 세포, 자연살상세포의 활성화 및 면역 반응에 관여함. SLAMF7 단백질끼리 결합을 할 수 있음.
- ○오토파지 (Autophagy): 자가소화작용. 세포 내부의 불필요하거나 기능하지 않는 구성 성분을 분해하는 파괴 기전.
- ○TCGA (The cancer genome atlas): 암 유전체에 대한 종합적인 정보를 제공하는 프로젝트. 다양한 유형의 암에 대한 유전적 변이, 유전자 발현, DNA 메틸화 등의 정보를 제공.
- ○이종이식 (Xenograft): 종이 다른 동물의 세포 또는 조직을 이식하는 방법.
- ○환자유래 암조직 이종이식기술 (Patient-derieved xenograft, PDX): 환자의 종양 세포를 면역 결핍 생쥐에 이식하여 생성한 암 모델.
[그림설명]
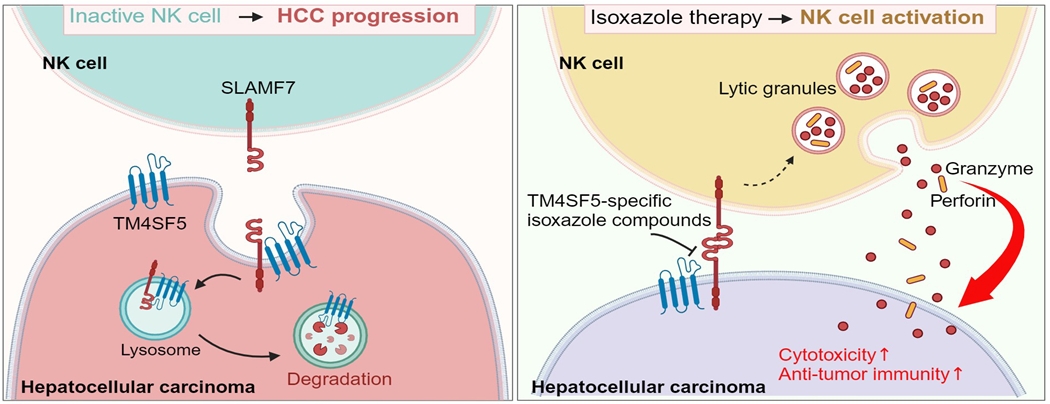
그림설명: TM4SF5와 SLAMF7의 상호작용에 따른 자연살상세포의 활성 조절에 따른 간암의 발병 및 억제 모식도: (왼쪽) 간상피세포에 TM4SF5가 과다발현되고 억제되지 않는 경우에, 세포막의 TM4SF5는 SLAMF7과 결합하고 세포 내부의 리소좀으로 이동하여 결국 SLAMF7가 분해되도록 유발함. 따라서, 자연살상세포의 막에 존재하는 SLAMF7 막수용체(리셉터, receptor)에 결합함으로써 자연살상세포의 활성화를 위한 과정이 불가능하여 간상피세포의 암화가 가능해짐. (오른쪽) 하지만, TM4SF5-특이적 아이소옥사졸과 같은 억제약물(TSIs)이 처리되면, TM4SF5와 SLAMF7의 결합을 억제하여, SLAMF7의 리소좀으로의 이동 및 분해가 억제되어, 결국 자연살상세포의 SLAMF7과 동종간의 결합을 이룸으로써, 자연살상세포의 활성화가 이루어져, 자연살상세포의 그랜자임 혹은 퍼포린 분비를 통해 간암의 상상이 가능해져 간암 유발이 저하됨.

