- 병원균의 자살 메커니즘의 규명: 새로운 기전의 항생제 개발의 포문을 열다 -
[연구필요성]
항생제 내성균은 전세계적으로 심각한 문제로 대두되고 있으며 특히 최근 발생한 코로나 바이러스로 인해 호흡기 감염병과 그 치료제에 대한 사회적 관심이 집중되어 있습니다. 코로나 바이러스에 감염된 환자는 세균에 의한 2차 감염에 취약하며 입원 환자의 경우 항생제 내성균에 의한 감염 발생 가능성이 높습니다. 따라서 현 사회적 상황을 고려하였을 때, 호흡기 감염병에 대한 항생제 내성을 극복하기 위한 새로운 기전의 항생제 개발이 필수적입니다. 안타깝게도 2020년 세계보건기구(WHO) 보고서에 따르면 대부분의 신규 항생제들은 슈퍼박테리아에 취약하며, 세계보건기구는 이러한 슈퍼박테리아를 인류 보건 건강의 10대 위협 중 하나라 발표 한 바 있습니다.
본 연구팀은 병원균의 항생제 내성 문제를 해결하기 위해 기존의 항생제와는 다른, 새로운 기전의 항생제 개발이 필요함을 인지하였습니다. 따라서 병원균에 내재한 독소 단백질의 제어를 방해하여 세포자살을 유도하는 기작을 토대로 하는 항생제의 새로운 기전을 고안하여, 이를 위하여 독소-항독소 단백질 연구를 수행하였습니다.
독소-항독소 단백질은 전사, 복제, 번역 등 병원균의 필수적인 세포 대사 과정에 관여하며 항생제 내성이나 지속적 감염 등에 주요한 역할을 한다고 알려져 있습니다. 본 연구에서 규명한 HEPN (higher eukaryotes and prokaryotes nucleotide-binding)-MNT (minimal nucleotidyltransferase) 독소-항독소 시스템은 기존에 밝혀진 6가지 독소-항독소 시스템과 다른 차별성을 가지고 있으며 제 7 유형 독소-항독소 시스템으로 분류되기도 합니다. 기존의 독소-항독소 시스템과 달리 항독소 번역 후 가공을 통하여 독소에 화학적 변형을 가하여 독소를 무력화 시키는 기전을 가지며 이 기전에 대한 추가적인 연구가 필요한 상황입니다. HEPN-MNT 는 고세균과 세균에서 가장 많이 존재하는 독소-항독소 시스템 중 하나로 이의 3차원 구조와 작동 메커니즘을 규명할 시 다양한 구조기반의 항생제의 개발로 응용 가능합니다. 또한 HEPN protein의 경우 인간의 초기 신경퇴행성질환에 관여하는 sacsin 단백질에도 존재하는 도메인으로 이의 구조와 기능 규명 시 항생제 뿐 아니라 다양한 질환의 메커니즘 규명과 치료제 개발에 활용 가능합니다.
[연구성과/기대효과]
〈연구 핵심내용〉
본 연구에서는 최초로 제7 유형HEPN-MNT 독소 항독소 시스템의 새로운 기전을 규명하고 이를 구조적으로 설명하였습니다. 이로서 더욱 혁신적인 약물 개발의 타겟을 제시하였습니다.
본 연구팀이 밝힌 표적 단백질인 독소단백질 HEPN의 경우 매우 독특한 방법으로 활성을 조절함을 밝혀내었습니다. 첫째, HEPN 독소 단백질은 용액 상에서 이량체, 사량체로 존재하여 이량체 간의 결합이 가능하고 이러한 결합을 통하여 사량체가 되어 스스로 활성부위를 가리는 자가 억제 기전을 가집니다. 둘째, 항독소인 MNT의 번역 후 가공 과정에 의해 3~4개의 ATP를 전달받아 그로 인해 활성부위에 입체 장애가 유발되어 그 활성이 억제됩니다. 저희는 이러한 독소 단백질의 독특한 활성 조절 기전을 다양한 방식으로 규명 하였습니다.
〈기대효과〉
현재 전 인류는 코로나 팬데믹을 겪으면서 바이러스로 유래한 거대한 위험을 실감하고 있습니다. 한편, 더 큰 위협이 될 수 있는 병원균에 의한 사망자 수는 증가하고 있으나 이에 따른 항생제 개발은 매우 느린 실정입니다. 특히 기존 항생제로 죽일 수 없는 슈퍼박테리아에 의한 사망자 수는 2017년에는 70만명(WHO보고서) 이상으로 알려졌는데 그 수는 급증하고 있습니다. 국내의 경우 2019년 기준 슈퍼박테리아 감염자는 9,000명이며 이 중40%인 3,600명이 사망했습니다. 세계보건기구(WHO)는 향후 2050년도에 슈퍼박테리아로 인한 사망자 수를1,000만 명 이상으로 예측합니다. 따라서 국가 보건 문제를 대비하기 위한 새로운 항생제 개발은 매우 시급한 실정입니다. 본 연구진은 이러한 사회적 요구에 대응하여 새로운 항생제 타겟의 구조와 그 작용기전에 대한 정보를 제시하였습니다. 이러한 타겟을 통해 기존의 항생제에 내성을 유발시킬 수 있는 약점 없이 병원균의 자살 유도를 한다는 점에서 완전히 다른 신규 항생제 개발이 가능합니다. 또한 신약 개발을 통해 국가의 위상이 향상되고, 국가의 수입을 증가시킬 수 있는 등 경제적인 효과가 상당할 것입니다.
[본문]
□ 연구의 필요성
연구동향과 선행연구의 한계 : 항생제 내성균은 전세계적으로 심각한 문제로 대두되고 있으며 특히 최근 발생한 코로나 바이러스로 인해 호흡기 감염병과 그 치료제에 대한 사회적 관심이 집중되어 있다. 코로나 바이러스에 감염된 환자는 세균에 의한 2차 감염에 취약하며 입원 환자의 경우 항생제 내성균에 의한 감염 발생 가능성이 높다. 따라서 현 사회적 상황을 고려하였을 때, 호흡기 감염병에 대한 항생제 내성을 극복하기 위한 새로운 기전의 항생제 개발이 필수적이다. 안타깝게도 2020년 세계보건기구(WHO) 보고서에 따르면 대부분의 신규 항생제들은 항생제 내성균인 슈퍼박테리아에 취약하며, 세계보건기구는 이러한 슈퍼박테리아를 인류 보건 건강의 10대 위협 중 하나라 발표 한 바 있다. 본 연구팀은 병원균의 항생제 내성 문제를 해결하기 위해 기존의 항생제와는 다른, 새로운 기전의 항생제 개발이 필요함을 인지하였다. 따라서 병원균에 내재한 독소 단백질의 제어를 방해하여 세포자살을 유도하는 기작을 토대로 하는 항생제의 새로운 기전을 고안하였고, 이를 위하여 독소-항독소 단백질 연구를 수행하였다.
독소-항독소 단백질은 전사, 복제, 번역 등 병원균의 필수적인 세포 대사 과정에 관여하며 항생제 내성이나 지속적 감염 등에 주요한 역할을 한다고 알려져 있다. 본 연구에서 규명한 HEPN (higher eukaryotes and prokaryotes nucleotide-binding)-MNT (minimal nucleotidyltransferase) 독소-항독소 시스템은 기존에 밝혀진 6가지 독소-항독소 시스템과 다른 차별성을 가지고 있으며 제 7 유형 독소-항독소 시스템으로 분류되기도 한다. 기존의 독소-항독소 시스템과 달리 항독소 번역 후 가공을 통하여 독소에 화학적 변형을 가하여 독소를 무력화시키는 기전을 가지며 이 기전에 대한 추가적인 연구가 필요한 상황이다. HEPN-MNT 는 고세균과 세균에서 가장 많이 존재하는 독소-항독소 시스템 중 하나로 이의 3차원 구조와 작동 메커니즘을 규명할 시 다양한 구조기반의 항생제의 개발로 응용 가능하다. 또한 HEPN protein의 경우 인간의 초기 신경퇴행성질환에 관여하는 sacsin 단백질에도 존재하는 도메인으로 이의 구조와 기능 규명 시 항생제 뿐 아니라 다양한 질환의 메커니즘 규명과 치료제 개발에 활용 가능하다.
□ 연구성과/기대 효과
1) 연구 핵심내용
(1) 제7유형의 독소-항독소 그룹에 속한 HEPN-MNT 단백질의 새로운 활성 제어 체계를 밝혔다. 사량체가 되어 스스로 활성부위를 가리는 자가 억제 기전과 항독소인 MNT 의 번역 후 가공 과정에 의한 활성 부위에 입체 장애유발 기전이다. 이러한 작용으로, 독소단백질의 알엔에이(RNA) 분해를 차단하는 것으로 확인된다.
(2) 독소단백질 HEPN은 용액 중에서 이량체(dimer), 사량체(tetramer)로 존재할 수 있으며 알엔에이를 분해하는 효소로 작용하는데, 이때 사량체 구조에서는 독소단백질의 구성요소 중 α2 - α3 loop가 활성 부위의 오목한 틈에 들어가 이를 입체적으로 가리고 있다.
- 평상시에는 병원균 내에서 독소 단백질은 이량체와 사량체로 존재하다, 영양소가 풍부한 환경이 되면 독소 단백질의 과다 생성으로 사량체 형태로 우세하게 존재하게 된다. 뿐만 아니라 영양소가 풍부한 환경에서 ATP가 다량 생성되면, 이에 따라 항독소인 MNT는 HEPN에 3~4개의 ATP를 전달해줌으로서 더욱 독소의 독성을 억제하게 된다.
(3) 독소단백질 HEPN은 리보솜알엔에이(rRNA)을 비롯한 다양한 알엔에이를 분해하는데, 이러한 분해로 레지오넬라균의 성장이 억제되며 결국 사멸에 이르게 된다.
(4) 또한 독소단백질 HEPN의 새로운 활성 잔기를 밝혔으며 이는 기존에 알려졌던 아미노산과 상이하여 더욱 그 신규성이 높다. 이러한 독소의 활성에 아미노산 Gln44, Glu47이 2가 금속인 마그네슘을 조정하며 중요한 역할을 함을 밝혀냈다.
(5) 종합적으로, 인체에는 존재하지 않으면서, 병원균의 자살을 유도할 수 있는 독소-항독소단백질 HEPN-MNT 단백질의 구조생물학적 연구를 통하여 새로운 항생제 개발의 포문을 열었다.
2) 본 연구결과의 지식증진 측면에서의 파급효과
(1) 레지오넬라균 유래의 제 7 독소-항독소 유형인 HEPN-MNT 단백질의 새로운 작용기전을 세계 최초로 규명하였다.
(2) 독소단백질이 사량체 형성을 통해 스스로 자기 억제 기전을 가지는 등 세균의 생존 전략을 새로 밝혀내었다.
(3) 독소단백질의 효소 활성화 부위에 결합한 항독소단백질의 구조를 밝혀 항독소단백질이 어떠한 방법으로 독소단백질을 제어하는지를 밝혀냈다.
(4) 전체적으로, 본 연구 결과는 생명과학 분야에 중요한 정보를 제공하고 있으며 더 나아가 인체 병원균의 생존 기작, 감염 후 기작 등에 관한 후속 연구 등을 수행하는데 밑바탕이 될 수 있다.
3) 본 연구결과의 실용화 측면에서의 파급효과
(1) 현재 전 인류는 코로나 팬데믹을 겪으면서 바이러스로 유래한 거대한 위험을 실감하고 있다. 한편, 더 큰 위협이 될 수 있는 병원균에 의한 사망자 수는 증가하고 있으나 이에 따른 항생제 개발은 매우 느린 실정이다.
- 특히 기존 항생제로 죽일 수 없는 슈퍼박테리아에 의한 사망자 수는 2017년에는 70만명 (WHO보고서) 이상으로 알려졌는데 그 수는 급증하고 있다. 국내의 경우 2019년 기준 슈퍼박테리아 감염자는 9,000명이며 이 중 40%인 3,600명이 사망했다.
- 세계보건기구(WHO)는 향후 2050년도에 슈퍼박테리아로 인한 사망자 수를 1,000만 명 이상으로 예측한다. 따라서 국가 보건 문제를 대비하기 위한 새로운 항생제 개발은 매우 시급한 실정이다. 또한 신약개발을 통해 국가의 위상이 향상되고, 국가의 수입을 증가시킬 수 있는 등 경제적인 효과가 상당할 것이다.
- 또한 기존의 항생제에 내성을 유발시킬 수 있는 약점 없이 병원균의 자살 유도를 한다는 점에서 완전히 다른 신규 항생제 개발이 가능하다.
[연구결과]
Structural insight into the distinct regulatory mechanism of the HEPN-MNT toxin-antitoxin system in Legionella pneumophila
Chenglong Jin, Cha-Hee Jeon, Heung Wan Kim, Jin Mo Kang, Yuri Choi, Sung-Min Kang, Hyung Ho Lee, Do-Hee Kim, Byung Woo Han & Bong-Jin Lee
(Nature Communications, https://doi.org/10.1038/s41467-024-54551-0)
[그림설명]
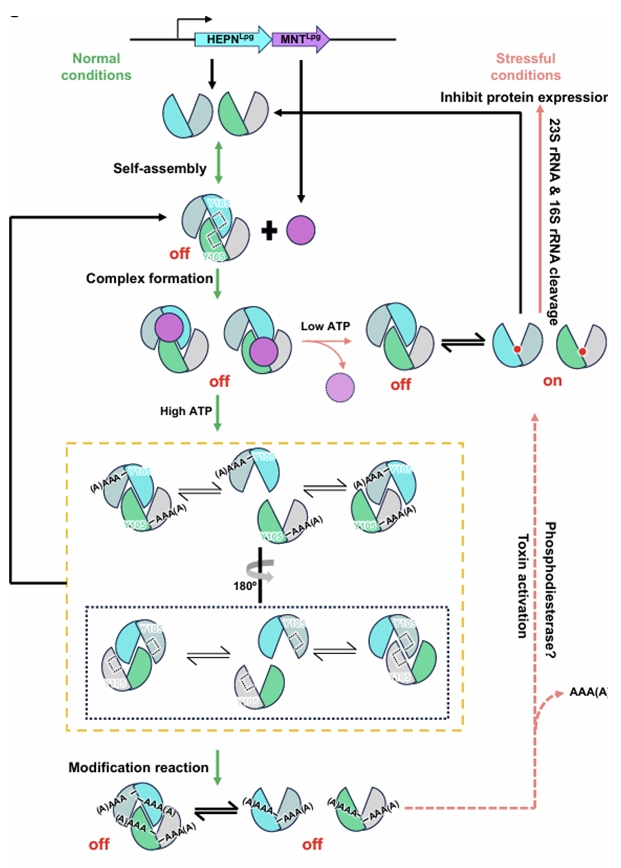
HEPN-MNT 독소-항독소 시스템의 새로운 작용 기전의 모식도
- 독소단백질 HEPN은 용액 중에서 이량체(dimer), 사량체(tetramer)로 존재할 수 있으며 알엔에이를 분해하는 효소로 작용하는데, 이때 사량체 구조에서는 독소단백질의 구성요소 중 α2 - α3 loop가 활성 부위의 오목한 틈에 들어가 이를 입체적으로 가리고 있다.
- 평상시에는 병원균 내에서 독소 단백질은 이량체와 사량체로 존재하다, 영양소가 풍부한 환경이 되면 독소 단백질의 과다 생성으로 사량체 형태로 우세하게 존재하게 된다. 뿐만 아니라 영양소가 풍부한 환경에서 ATP가 다량 생성 되면, 이에 따라 항독소인 MNT는 HEPN에 ATP를 전달해 줌으로서 더욱 항독소의 독성을 억제하게 된다.
- 독소단백질 HEPN은 리보솜알엔에이(rRNA)을 비롯한 다양한 알엔에이를 분해하는데, 이러한 분해로 레지오넬라균의 성장이 억제되며 결국 사멸에 이르게 된다.
- ○항생제 내성균은 전세계적으로 심각한 문제로 대두되고 있으며 특히 최근 발생한 코로나 바이러스로 인해 호흡기 감염병과 그 치료제에 대한 사회적 관심이 집중되어 있습니다. 코로나 바이러스에 감염된 환자는 세균에 의한 2차 감염에 취약하며 입원 환자의 경우 항생제 내성균에 의한 감염 발생 가능성이 높습니다. 따라서 현 사회적 상황을 고려하였을 때, 호흡기 감염병에 대한 항생제 내성을 극복하기 위한 새로운 기전의 항생제 개발이 필수적입니다. 안타깝게도 2020년 세계보건기구(WHO) 보고서에 따르면 대부분의 신규 항생제들은 슈퍼박테리아에 취약하며, 세계보건기구는 이러한 슈퍼박테리아를 인류 보건 건강의 10대 위협 중 하나라 발표 한 바 있습니다.본 연구팀은 병원균의 항생제 내성 문제를 해결하기 위해 기존의 항생제와는 다른, 새로운 기전의 항생제 개발이 필요함을 인지하였습니다. 따라서 병원균에 내재한 독소 단백질의 제어를 방해하여 세포자살을 유도하는 기작을 토대로 하는 항생제의 새로운 기전을 고안하여, 이를 위하여 독소-항독소 단백질 연구를 수행하였습니다.
- ○기존에 알려진 바와 다른, 새로운 기전에 대하여 규명하다 보니, 세포 수준의 활성 실험이나, 다량체 형성의 증명 등 생물리학적 검증이 복잡하였습니다. 그러나 다양한 연구그룹과 협업을 통하여 SPR, DLS, AUC 등 다양한 방식으로 용액상의 다량체 형성을 검증할 수 있었고, 세포 수준에서의 단백질의 활성을 검증하며 저희의 가설을 입증하였습니다.
- ○병원성균 유래 독소-항독소 단백질은 병원균의 독성 및 생존에 중요한 역할을 함으로 여러 방면으로 연구가 되어 왔습니다. 본 연구팀이 밝힌 표적 단백질인 항독소단백질 HEPN의 경우 매우 독특한 방법으로 활성을 조절함을 밝혀내었습니다. 저희는 SPR, DLS, SEC 등 다양한 실험 방법을 통하여 용액 상에서 독소 단백질이 이량체, 사량체로 존재하여 이량체 간의 결합이 가능하고 이러한 결합을 통하여 사량체가 되어 스스로 활성부위를 가리는 자가 억제 기전을 가진다는 것을 증명하였습니다. 또한, 구조결정법과, 질량분석법을 활용하여 HEPN은 항독소인 MNT 의 번역 후 가공 과정에 의해 3~4개의 ATP를 전달 받는다는 것을 증명하였고 그로 인해 활성 부위에 입체 장애가 유발되어 그 활성이 억제될 수 있음을 구조적으로 설명하였습니다.

