- 단분자 이미징을 활용한 동반진단 PPI 바이오마커 개발 및 미국에서 대규모 임상 검증 수행 -
[연구필요성]
혈액암의 일종인 급성 골수성 백혈병 (AML)은 혈액 또는 골수 내 비정상 백혈구가 급격히 증식하여 정상 혈액 세포의 생성이 방해되는 질병으로, 신속하고 효과적인 치료법의 선택이 무엇보다 중요하다. BH3 모사체 (BH3 mimetics)는 이러한 혈액암 환자들을 대상으로 개발된 표적 항암제로, 특히 BCL2 단백질을 표적하는 ABT-199 (Venetoclax)는 AML을 비롯한 혈액암 치료에 높은 성과를 나타내고 있다.
이러한 성공에도 불구하고 해당 항암제가 모든 환자에게 동일한 치료 효과를 제공하지 못하며, 일시적 관해 후 저항성이 발생하는 사례가 보고됨에 따라 ABT-199의 효과를 사전에 예측할 수 있는 방법의 개발이 요구되고 있다.
[연구성과/기대효과]
연구팀은 단분자 공면역침강 (SMPC) 기술을 활용하여 약 백만개의 검체 세포로부터 20종 이상의 서로 다른 단백질-단백질 상호작용 (PPI) 신호를 정량적으로 검출하는 기술을 개발하였다. 특히 30여 례의 AML 환자 검체를 활용하여 획득한 다차원 PPI 프로파일 데이터와 생체 외 수준 (ex vivo) 에서의 약물 반응성 사이의 상관관계 분석을 통해 약물의 작동에 주요한 PPI 복합체를 밝혀내어, 이를 기반으로 하는 고성능 예측 바이오마커를 제작하였다. 연구팀은 본 연구를 통해 개발한 바이오마커가 AML 환자의 치료 결정에 중요한 가이드라인이 되어 환자 개개인에게 맞춤형 치료 전략을 제시함으로써 보다 효과적인 치료를 제공할 수 있을 것으로 기대하고 있다.
[본문]
서울대학교 생명과학부 윤태영 교수·서울대병원 혈액종양내과 고영일 교수 · 서울대학교 의과대학 내과학교실 변자민 교수·주식회사 프로티나 공동연구팀은 단분자 기술을 응용, ABT-199 표적 항암제의 치료 효과를 예측할 수 있는 고성능 동반진단 바이오마커를 개발하였다.
연구팀은 BCL2 단백질군 내 PPI 네트워크로 대변되는 단백질 복합체의 역동성에 주목하여, BH3 모사체의 세포자살 조절 기전을 분석하였다. 이에 연구팀은 단분자 공면역침강으로 구성된 SMPC 기법을 개발, 총 22종의 BCL2 계열 PPI 신호 검출 방법을 확립하였다. 단분자 형광 이미징 기법을 활용한 해당 기술은 높은 민감성을 바탕으로 약 3만 여개의 미량 세포 검체로부터 개별 PPI 신호의 정량적 분석이 가능하다.
해당 기술을 통해 연구팀은 세포자살의 진행에 따른 AML 세포주 내 PPI 네트워크의 변화를 정량적으로 추적하였다. 세균 독소에 의해 유도되는 일반적인 세포자살 과정에서 AML 세포의 생존에는 BCL2-BAX 단백질 복합체가 주요 매개체로 작동하며, 특히 ABT-199는 BCL2 단백질에 선택적으로 결합, 해당 복합체를 해리하여 활성화 BAX 단백질의 상승을 유도하는 것으로 세포자살을 야기함이 확인되었다. 연구팀은 해당 결과를 바탕으로 기존에 명확하게 설명되지 않는 ABT-199의 작동 기전 (Mode of action)의 핵심 과정을 밝혀내었다.
해당 발견에 힘입어 연구팀은 32명의 실제 AML 환자로부터 공여받은 검체를 대상으로 대규모 PPI 신호 프로파일링을 수행하였다. 획득한 다차원 PPI 프로파일 데이터는 동일 코호트의 ABT-199에 대한 생체 외 수준 약물 반응성과의 상관관계 분석을 통해 ABT-199 반응성에 영향을 주는 주요 지표인 BCL2-BAX 복합체 및 BCLxL-BAK 복합체가 검출되었다. 이때 BCL2-BAX 복합체는 ABT-199의 민감성, 그리고 BCLxL-BAK 복합체는 저항성과 각각 연관되어 있음이 밝혀져 항암제의 작동 기전을 명확히 반영하고 있음을 밝혔다.
이를 종합하여, 연구팀은 개별 AML 환자의 ABT-199 약물 반응성을 높은 정확도로 예측하는 바이오마커 개발에 성공하였다. 개발한 바이오마커의 예측 정확도는 생체 외 수준에서 최대 0.94의 AUC-ROC (Area Under Curve of Receiver Operating Characteristic)에 이른다.
특히 해당 바이오마커는 임상 수준의 반응성에 대한 예측력을 확보하여, 서울대학교병원에서 추적한 10명의 실제 AML 환자 중 9명의 항암제 반응성을 예측하는데 성공하였다. 최종적인 민감도 및 특이도는 각각 100%, 83.3%로 확인되었으며, 이는 임상 수준에 적용 가능한 수치이다.
공동교신저자 윤태영 교수는 “SMPC 기법은 모든 종류의 시료에서 PPI를 측정할 수 있는 보편적인 도구”라며, “복잡한 단백질 상호작용 네트워크를 이해하는 것은 분자 진단의 새로운 길을 열어줄 것”이라고 연구의 의의를 전했다. 윤태영 교수 연구팀은 SMPC 기술의 적용 범위 확장을 위해 후속 연구를 수행하고 있음을 밝혔다.
서울대병원 임상의이자 공동교신저자인 고영일 교수는 “그간 반응예측 바이오마커가 마땅치 않던 AML에서의 Venetoclax 요법에 큰 의미가 있는 연구”라며, “PPI 프로파일링 기반의 본 연구가 향후 AML의 정밀의료에 큰 도움이 될 것”이라고 본 연구의 중요성을 강조했다.
연구팀은 본 연구를 통해 개발한 바이오마커가 AML 환자의 치료 결정에 중요한 가이드라인이 되어 환자 개개인에게 맞춤형 치료 전략을 제시함으로써 보다 효과적인 치료를 제공할 수 있을 것으로 기대하고 있다.
2024년 현재 프로티나는 서울대학교 및 서울대학교병원으로부터 본 기술의 특허를 인계받아 실제 진단 도구로써 상용화를 시도하고 있다. 특히 프로티나는 미국 혈액암 학회의 승인 하에 BEAT AML trial에 속한 혈액암 샘플들을 이용하여 미국에서 대규모 임상 검증을 수행하고 있다. 이 임상 검증은 애틀란타 소재 에모리대학교 (Emory University, Atlanta) 의과대학 우장희 교수 연구팀과 협력하여 에모리 대학교 Winship Cancer Center에서 이루어지고 있다.
본 연구 결과는 이와 같은 연구성과를 인정받아 이 분야의 세계적인 학술지인 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering, IF=29.2)에 개제된다. 본 연구는 한국연구재단 (NRF) 의 리더연구자지원사업 및 바이오의료기술개발사업, 그리고 한국보건산업진흥원 (KHIDI) 의 보건의료R&D사업의 지원을 받아 수행되었다.
[연구결과]
Profiling protein-protein interactions to predict the efficacy of B-cell-lymphoma-2-homology-3 mimetics for acute myeloid leukaemia
Changju Chun, Ja Min Byun, Minkwon Cha, Hongwon Lee, Byungsan Choi, Hyunwoo Kim, Saem Hong, Yunseo Lee, Hayoung Park, Youngil Koh, and Tae-Young Yoon
(Nature Biomedical Engineering, July 2024, https://www.nature.com/articles/s41551-024-01241-3)
B-cell-lymphoma-2 (BCL2) homology-3 (BH3) 모사체는 BCL2 계열의 항-세포자살 단백질을 포화시켜 암세포에 세포자살을 유도하는 단백질-단백질 상호작용(PPI) 억제제이다. BH3 모사체 중 하나인 ABT-199는 혈액 악성종양 치료에 대해 큰 성공을 거두었음에도 불구하고, 환자 중 일부만이 약물에 반응하며 대부분의 환자는 결국 약물에 대한 저항성을 획득하게 된다. 이에 본 연구팀은 단분자 풀다운 (pull-down) 및 공면역침강 (co-immunoprecipitation) 기술을 통해 BCL2 계열 내 PPI 네트워크의 재배열된 상태를 프로파일링함으로써 ABT-199의 효능을 예측하는 진단 모델을 개발하였다. 연구단은 약 1.2백만 여 개의 세포 검체로부터 20종 이상의 PPI 신호를 정량적으로 검출하였으며, 획득한 다차원 데이터 및 BH3 모사체의 생체 외 수준 (ex vivo) 반응성을 비교하는 것으로 약물 반응을 결정하는 두 종류의 서로 다른 BCL2 계열 복합체를 특정화할 수 있었다. 이를 바탕으로 구축된 ABT-199 반응성 예측 모델은 높은 정확도로 환자 개개인의 약물 반응성을 진단하고 효과적인 치료 전략을 제공한다.
- ○세포자살 (Apoptosis): 세포가 계획된 방법으로 자발적으로 사멸하는 과정으로, 암세포와 같은 손상된 세포를 체내에서 안전하게 제거할 수 있도록 하는 기작.
- ○바이오마커 (Biomarker): 질병의 진단, 진행, 또는 치료 반응 등을 객관적으로 측정하고 평가할 수 있도록 고안된 생물학적 지표.
- ○BCL2 단백질군 (BCL2 protein family): 내인성 세포자살 경로를 조절하는 단백질군으로, 세포의 생존을 조절하는 항-세포자살 단백질 (anti-apoptotic protein)과 친-세포자살 단백질 (pro-apoptotic protein)으로 구성됨.
- ○BH3 모사체 (BH3 mimetics): BCL2 단백질군 내 항-세포사멸 단백질에 결합하여 세포자살을 유도하는 저분자화합물 항암제.
- ○AUC-ROC (Area Under Curve of Receiver Operating Characteristic): 진단 모델의 성능을 평가하기 위한 지표로, 모델의 민감도 및 특이도 간의 관계를 나타냄.
[그림설명]
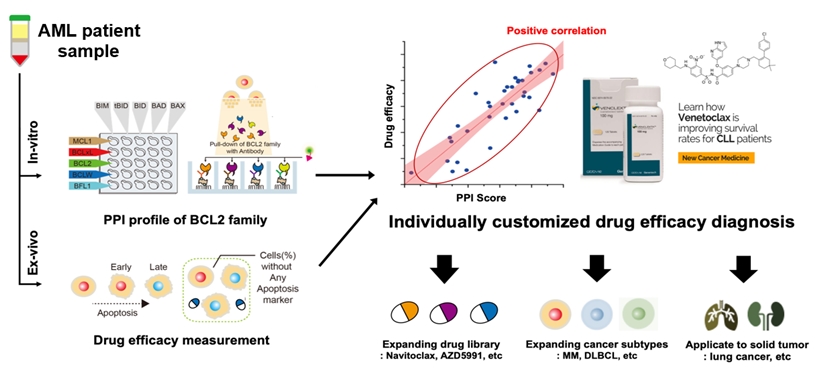
그림 1 – 혈액암 검체 내 BCL2 계열 PPI 프로파일링을 통한 항암제 반응성 진단 모식도

그림 2 – Beat AML trial 참여를 통한 본 연구기술의 글로벌 임상 검증

