- 코엔자임 Q 유도체 투여를 통한 시신경위축증 모델의 미토콘드리아 기능 회복 -
[연구필요성]
미토콘드리아는 세포 내에서 에너지를 생성하는 주요 세포 소기관으로 다양한 조직에서 서로 다른 대사 활동을 수행한다. 미토콘드리아 내의 단백질 구성은 특정 조직의 고유한 대사 요구에 따라 다를 것으로 추측되나, 그 구체적인 내용은 아직 완전히 밝혀지지 않았다. 기존 미토콘드리아 단백질 분석 방법으로는 주로 세포 소기관을 분리한 후 질량 분석법을 적용했으나, 동일한 근육 표본에서도 미토콘드리아가 아닌 단백질들의 오염으로 인한 불일치가 발생하곤 했다. 또한 기존 방법들은 미토콘드리아 내에서 보다 더 구체적이고 복잡한 공간 정보를 제공하는 데 한계가 있었다. 따라서, 미토콘드리아 단백질의 조직별 차이를 정확하게 이해하기 위한 새로운 방법론의 필요성이 대두되었다.
[연구성과/기대효과]
본 연구팀은 엔지니어링된 과산화효소(APEX) 및 근접분자 표지기술을 응용한 단백질 동정 기술을 마우스 미토콘드리아에 적용하였다. 미토콘드리아 기질 위치에 APEX를 발현하는 유전자 변형 마우스를 도입하여 다양한 조직에서 미토콘드리아 기질 내에 위치한 단백질들을 동정하는 데 성공하였다. 이 특수한 마우스 모델을 사용하여 근육과 심장 조직 미토콘드리아의 단백질 구성을 조사한 결과, 심장 조직에서는 지방산 베타 산화 (fatty acid beta oxidation)을 통한 에너지 생성 경로가, 그리고 근육 조직에서는 호흡복합체 (OXPHOS complex)를 통한 에너지 생성 경로가 활발함을 밝혀냈다. 이는 조직마다 고유한 미토콘드리아 대사의 특징이 존재함을 보여준다. 또한 이들 조직에서 공통되게 발견된 RTN4IP1(OPA10) 단백질이 기존의 알려진 세포 내 위치와 다르게 미토콘드리아 기질에 위치함을 확인하였다. 나아가, RTN4IP1(OPA10)이 코엔자임 Q10(Coenzyme Q10) 합성에서 필수 구성 요소임이 생합성 관련 메커니즘과 함께 규명되었다. 이 연구의 결과는 미토콘드리아 단백질의 조직별 특이성을 깊게 이해하는 데 크게 기여할 것으로 기대되며, RTN4IP1(OPA10)과 관련한 새 발견은 기존 코엔자임 Q와 관련된 질병의 진단 및 치료에 중요한 열쇠가 될 것으로 기대된다.
[본문]
세포의 에너지 공장인 미토콘드리아는 우리 몸에서 에너지를 생성하는 중심적인 역할을 한다. 이 에너지 생성 과정에서 코엔자임 Q (CoQ)는 필수적인 존재로 알려져 있다. 본 연구팀은 CoQ 합성 과정에 중요한 역할을 하는 단백질 RTN4IP1(OPA10)의 중요성을 집중 조명하게 되었다. 본 연구팀은 미토콘드리아 내의 특정 단백질 구성을 탐구하는 새로운 접근 방식인 APEX를 이용한 근접분자 표지기술을 한 단계 더 업그레이드한 초고해상도 근접분자 표지기술인 Spot-ID 기술을 동물 모델 시스템인 쥐에 적용하여 RTN4IP1(OPA10) 단백질이 포유동물인 쥐의 근육조직의 미토콘드리아의 기질에 존재함을 정밀하게 파악하였다.
이후 본 연구팀은 RTN4IP1(OPA10)이 근육 미토콘드리아 기질에서 어떤 기능을 수행할 것인지에 대한 의문을 갖고 단백질 구조 분석, 대사체 분석, RTN4IP1(OPA10) 효소활성 시험관 반응 등의 다양한 실험을 진행하였다. 일련의 실험결과를 바탕으로 본 연구팀은 RTN4IP1(OPA10)이 미토콘드리아 기질에서 주로 진행되는 코엔자임 Q (CoQ)의 합성 과정에서 중요한 역할을 하는 것으로 확인하였다. 코엔자임 Q는 세포의 에너지 전달 과정에서 핵심적인 역할을 한다. 특히, 세포의 호흡 작용에서 전자를 전달하는 중요한 중개자로 기능하며, 이 과정에서 에너지는 ATP의 형태로 저장된다. RTN4IP1(OPA10)기능의 규명은 CoQ의 합성이 이루어지는 상세한 과정을 이해하는 데 중요한 열쇠가 될 것으로 보인다. 연구팀은 RTN4IP1(OPA10) 단백질은 미토콘드리아 기질 위치에서 CoQ의 합성에 필수적인 요소로 작용하며, 이러한 과정은 포유동물의 근육 조직 뿐만이 아니라 초파리 근육 조직활성을 유지하는데 중요한 역할을 수행함을 밝혔다. 이번 연구는 미토콘드리아 내의 RTN4IP1(OPA10)과 CoQ의 합성 과정 사이의 관계를 깊이 이해하게 되면서, 인체내 CoQ 부족으로 인해 발생하는 질병의 치료법 개발로 이어질 수 있는 새로운 연구 방향성을 제시할 것으로 기대된다. 또한 MAX-Tg 마우스 모델을 활용하여 노화와 만성 대사성질환 모델 연구에 도움을 줄 것으로 기대된다.
[연구결과]
저널링크 : https://www.nature.com/articles/s41589-023-01452-w
- -근접분자 표지기술을 마우스 모델에 적용하여 Matrix-APEX2 Tg mouse (MAX Tg mouse) 제작 및 효소의 활성 확인.
- -근접분자 표지기술을 통해 마우스 조직별 미토콘드리아 기질 단백질체 동정 완료.
- -심장 조직에서는 지방산 베타 산화 (fatty acid beta oxidation)을 통한 에너지 생성 경로가 그리고 근육 조직에서는 호흡복합체 (OXPHOS complex)를 통한 에너지 생성 경로가 활발함을 밝혀냄.
- -근접분자 표지기술을 통해 마우스 조직별 미토콘드리아 기질 단백질체 동정 완료.
- -심장 (heart), 가자미근 (soleus)에서 높은 발현을 보이는 RTN4IP1(OPA10) 발견. RTN4IP1(OPA10)의 위치가 기존에 알려진 미토콘드리아 외막이 아닌 기질 안쪽임을 규명.
- -근접분자 표지기술을 이용한 RTN4IP1(OPA10)과 상호작용 할 것으로 예상되는 단백질 후보 확보.
- -RTN4IP1(OPA10)이 기존 Coenzyme Q 생합성에 관여한다고 알려진 COQ3 단백질과 직접적으로 상호작용 하는 것을 밝힘. Coenzyme Q가 전구체에서 합성되는 과정에서 COQ3는 O-methylation 반응을 담당하게 되는데, RTN4IP1(OPA10)과 NAD(P)H가 함께 제공되어야만 이러한 COQ3의 O-methylation 반응이 효율적으로 일어남을 확인.
- -Coenzyme Q 결핍 세포에서의 호흡활성 저하와 Coenzyme Q 생성 결핍 확인. RTN4IP1(OPA10)의 재발현 시 Coenzyme Q와 호흡활성의 일부 회복을 확인.
- -Coenzyme Q 결핍 초파리 모델에서의 Coenzyme Q 생성 결핍과 운동 능력 이상 확인. 수용성의 Coenzyme Q 처리 시 일부 운동 능력 회복을 확인.
서울대학교(SNU) 화학부 이현우 교수, 생명과학부 김종서 교수, 한국과학기술원(KAIST) 서재명 교수, 및 한국생명공학연구원(KRIBB) 이규선 박사 연구팀으로 이루어진 공동 연구팀은 세포 내 에너지 생성의 중심인 코엔자임 Q (CoQ) 합성에 필수적인 단백질 RTN4IP1(OPA10)의 중요성을 밝혔다고 발표했다.
이 연구팀은 근접분자 표지기술을 마우스 모델에 활용하여 RTN4IP1(OPA10) 단백질이 세포 내 코엔자임 Q 생합성에서 중요한 역할을 담당함을 발견했다. 근접분자 표지기술은 특정 단백질의 주변에 있는 다른 단백질들을 정밀하게 식별할 수 있는 기술로써, 특정 세포소기관의 단백질체와, 특정 단백질의 주변 단백질체를 연구할 수 있도록 돕는다.
공동연구팀은 RTN4IP1(OPA10) 단백질이 기존에 코엔자임 Q 생합성에 관여하는 것으로 알려진 COQ3 단백질과 직접적으로 상호작용함을 발견하였다. 코엔자임 Q는 세포의 에너지 생산에서 중요한 역할을 하는 물질로, 이의 생합성이 잘 이루어지지 않을 경우 시력 손실, 근육의 기능 저하 등 다양한 질병의 원인이 될 수 있다.
연구팀은 실제로 RTN4IP1(OPA10) 단백질의 결핍이 세포 내 코엔자임 Q의 생산을 저하시키는 것을 확인하였으며 실험실 환경의 세포에서 뿐 아니라, 초파리 모델에서도 RTN4IP1(OPA10) 단백질의 결핍이 심각한 코엔자임 Q 결핍과 운동 능력 약화를 가져옴을 확인하였다. 이러한 운동능력의 저하는 코엔자임 Q 보충을 통해 상당 부분 회복되었다.
공동연구에 1저자로 참여한 박이삭 연구원은 “RTN4IP1이 기존에 알려진 코엔자임 Q 관련 단백질들과 상호작용하며 코엔자임 Q 생합성에 깊게 관여함을 확인하였다. 이번 연구를 통해 RTN4IP1 단백질의 위치 정보를 수정하고, 중요한 기능을 발견하게 되어 매우 기쁘다”며, “이를 바탕으로 코엔자임 Q와 관련된 다양한 질병의 치료 방안을 새롭게 모색할 수 있을 것”이라고 밝혔다. 이현우 교수 역시 “근접분자 표지기술을 활용하여 조직 특이적인 미토콘드리아 단백질체 구성과, RTN4IP1의 기능을 규명할 수 있었다. 이렇게 중요한 결과를 얻을 수 있어서 매우 뜻깊게 생각한다”고 전했다.
이번 연구에서 서울대학교 화학부 이현우 교수 연구실은 초고해상도 근접분자 표지기술을 개발 및 활용하여 심장과 근육 조직에서 RTN4IP1(OPA10)을 발견하고, RTN4IP1(OPA10)의 인접 단백질을 분석하는 연구를 수행하였다. 카이스트 의과학대학원 서재명 교수 연구실은 RTN4IP1(OPA10) 결핍 세포 제작과 해당 세포에서의 대사 활동 분석을 진행하였다. 서울대학교 생명과학부 김종서 교수 연구실은 단백체 질량 분석과 코엔자임 Q와 관련된 대사체 질량 분석을 진행으며, 한국생명공학연구원 이규선 박사 팀은 RTN4IP1(OPA10) 결핍 초파리 모델 제작 및 행동 분석을 수행하였다.
이번 연구는 Nature Chemical Biology 저널 (Impact factor : 16.284)에 2023.10.27.일자로 발표되었으며, 이 연구를 통해 미토콘드리아 기질 단백질로 새롭게 밝혀진 RTN4IP1(OPA10)의 중요성 및 기능, 그리고 Coenzyme Q와의 관계에 대한 깊은 이해를 얻을 수 있게 되었다. 이를 통해 인체내 CoQ 부족으로 인해 발생하는 시신경위축증 등의 질병의 치료법 개발로 이어질 수 있는 새로운 연구 방향성을 제시할 것으로 기대되며, 근접분자 표지기술 마우스 모델을 활용하여 노화와 만성 대사성질환 모델 연구에 도움을 줄 것으로 기대된다.
이번 연구는 한국연구재단, 한국뇌연구원, 기초과학연구원, 삼성미래기술육성사업, 한국산업기술평가관리원의 알키미스트 프로젝트의 지원을 받아 수행되었다.
- ○시신경위축증: 시신경에 발생하는 손상이나 기능 장애를 의미하며, 이로 인해 시력 저하, 시야 결손 등의 증상이 발생할 수 있음. 미토콘드리아의 기능 장애가 시신경위축증의 주요 원인 중 하나로 꼽힘.
- ○공간대사학: 세포 내에서 대사물 및 단백질의 위치와 분포를 공간적으로 해석하는 학문. 이는 생화학적 반응의 위치, 대사 경로의 활성화 위치, 단백질-대사물 간의 상호 작용 위치 등을 조직이나 세포의 구체적인 위치에 따라 시각화하고 분석하는 데 중점을 두게 됨.
- ○RTN4IP1(OPA10): Reticulon-4-interacting protein 1이라는 이름의 미토콘드리아 단백질이며 또 다른 이름으로는 Optic atrophy 10 (OPA10)이라고 불림. RTN4IP1 단백질을 발현하는 유전자에 변이가 있을 경우, 이름 그대로 optic atrophy (시신경위축증) 증상이 나타나는 것으로 보고됨.
- ○근접분자 표지기술: 근접분자 표지기술은 단백질이 특정 특정 효소와 가까이 있을 때, 해당 단백질에 특정 표지(tag)를 부착하는 기법. 이 방법은 세포 내에서 특정 단백질의 상호작용 파트너나 해당 단백질의 위치와 인접한 세포 내 구조를 식별하는 데 사용됨.
- ○코엔자임 Q: 미토콘드리아에서 생성되고 발견되는 물질로서, 전자 전송 체인에서 중요한 역할을 하는 항산화제. 인간의 체내에서는 주로 '코엔자임 Q10' 형태로 존재하며, 에너지 생산과 활성 산소로부터 세포를 보호하는 역할.
[그림설명]
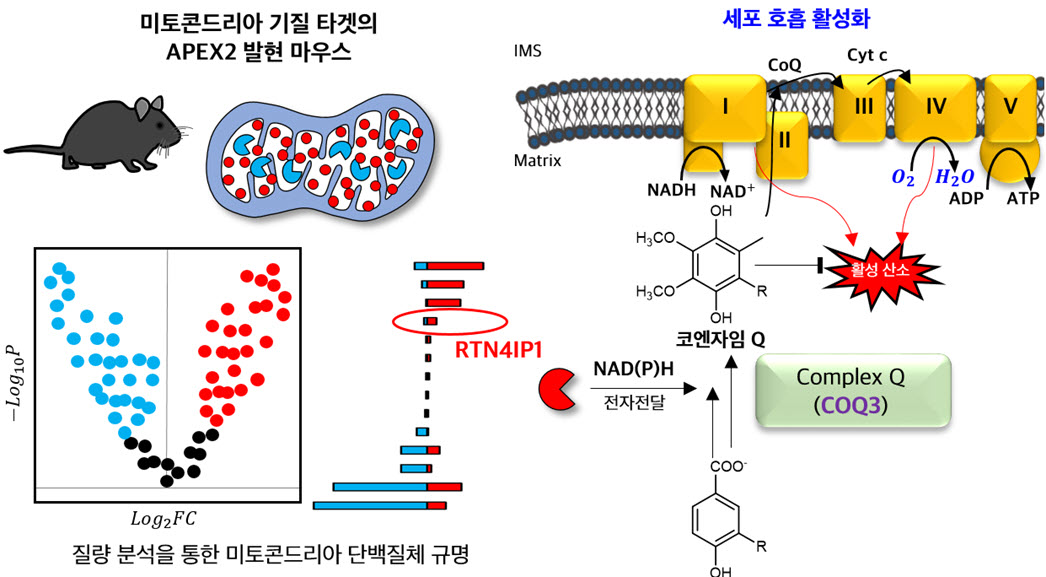
Graphical Abstract. 근접분자 표지기술을 활용한 마우스 미토콘드리아 기질 단백질체 분석 수행 및 이를 통해 발견한 RTN4IP1 단백질의 코엔자임 Q 생합성 참여 메커니즘과 코엔자임 Q의 역할을 표현.

