- 신경세포 내 액체방울 형성제어에 의한 조울증 유발 핵심단백질의 가소성 조절 기전을 규명
[연구필요성]
서울대 의과대학 장성호 교수 연구팀은 조울증과 지적장애의 핵심 원인 단백질인 nArgBP2의 작용기전에 관해 연구하여, 2016년 미성숙한 신경세포에서의 nArgBP2의 결핍이 비정상적인 형태의 수상돌기 가시 형성을 초래하고 흥분성 시냅스 발달을 저해하여, 신경계 흥분성/억제성 신호의 불균형을 유발함을 규명하였고, 이것이 조울증의 원인으로 작용할 수 있음을 제시한 바 있다 (PNAS, 2016).
흥미롭게도 연구팀은 미성숙한 신경세포에서와는 달리, 성숙한 신경세포에서는 nArgBP2의 결핍이 활성화되지 않은 신경세포에서는 어떠한 신경세포의 구조 형태학적 결함을 보이지 않는다는 사실을 발견하였다.
그러나 성숙한 신경세포에서도 시냅스 장기강화를 통해 활성화를 유도하면 nArgBP2의 결핍이 시냅스의 구조적 가소성을 억제하는 현상을 발견하였다.
본 연구는 성숙한 신경세포에서 nArgBP2가 신경 활성화에 따라 어떻게 다르게 작동하는가, 어떻게 신경 구조적 가소성을 조절하는가를 규명하기 위하여 진행되었다.
[연구성과/기대효과]
연구진은 살아있는 세포 및 세포 외 연구에서 nArgBP2 단백질이 액체-액체 상 분리 현상으로 외부와 구별된 액상 응집체를 이루고 있다는 사실을 발견하였다.
응집된 nArgBP2는 시냅스 장기강화를 통한 활성화 유발 시 칼슘/칼모듈린 의존 단백질 인산화효소 (CaMKIIα) 에 의해 분해되고, 액상 응집체로부터 유리된 nArgBP2는 액틴 세포골격 형성에 관여하는 다른 단백질과의 상호작용으로 신경 수상돌기 가시의 구조적 가소성 및 시냅스 신호전달을 조절함을 규명하였다.
본 연구는 액상 간 상 분리 현상이 실제로 살아있는 신경세포 내에서 생리학적 기전을 영향을 줄 수 있음을 규명한 중요한 연구결과로, nArgBP2 액상 응집체의 이상현상이 조울증 및 지적장애 질환의 원인 기전일 수 있음을 제시하였다.
나아가 nArgBP2가 강박 장애, 자폐증의 원인으로 알려진 신경계 단백질들과 활발하게 상호작용하므로, 본 연구의 결과는 관련된 다양한 기분장애 및 신경정신질환의 유발 기전 및 세포 내 상호작용기작 규명 연구에 기여할 수 있을 것으로 기대된다.
[본문]
현 사회에서 조울증은 높은 속도로 증가하는 질환 중 하나다. 국민건강보험공단에 따르면 2020년 조울증 진단을 받은 환자는 11만 1731명으로, 2016년에 비해 35.2% 증가세를 보였다. 이처럼 가파른 증가에도 조울증 등 다양한 신경정신질환의 명확한 기전은 여전히 밝혀지지 않아 이에 관한 지속적인 연구가 필요하다.
최근 연구들에서 세포 내에서 다양한 단백질들이 유동성을 가진 응집체로써 뭉치는 액체-액체 상 분리 현상을 일으킨다고 보고되었다. 또한, 이러한 현상이 알츠하이머, ALS 등 다양한 뇌 질환 유발의 새로운 주요 기전으로 제시되었다. 그러나 대부분의 연구가 분리된 단백질을 시험관 내에서 확인했기 때문에, 실제로 세포 내에서 상 분리 현상이 세포의 생리학적 기전 조절과 관련 있는지는 논란으로 남아 있다.
서울대학교 의과대학 장성호 교수 연구팀은 2016년 조울증과 지적장애의 핵심 원인 단백질인 nArgBP2의 신경계 내 결핍이 발달 중인 신경 세포에서 비정상적인 형태의 수상돌기 가시 형성에 영향을 끼쳐 신경계 흥분성/억제성 신호의 불균형을 유발함을 규명하고, 이 기작이 조울증 유발의 신경생리학적 기전이라는 사실을 규명한 바 있다 (조울증 유발 단백질의 핵심 메커니즘 규명 출처: [BRIC Bio 통신원] 조울증 유발 단백질의 핵심 메커니즘 규명…. 서울대학교 장성호 교수팀 ( https://www.ibric.org/myboard/read.php?Board=news&id=272599 ).
하지만 추후 계속된 연구에서, 미성숙 신경세포에서와는 달리, 수상돌기 가시가 이미 형성된 후인 성숙한 신경 세포에서는 nArgBP2의 발현을 억제해도 기존 수상돌기 가시의 형태에 영향을 미치지 않으나, 신경계 학습과 기억과정의 기전인 신경가소성을 유발하였을 때에는 수상돌기 가시의 크기증가를 억제한다는 사실을 발견하였다.
연구팀은 어떻게 활성화되지 않은 성숙한 신경세포에서 nArgBP2의 발현 억제가 신경세포에 아무런 영향을 끼치지 않으나, ‘시냅스 장기강화 (synaptic long-term potentiation)’ 자극을 통하여 활성화가 유도된 신경세포에서는 nArgBP2의 발현 억제가 심각한 구조적 가소성 유발을 억제하는지에 대한 신경생리학적 기전을 연구하였다.
[연구결과]
Biomolecular condensate assembly of nArgBP2 tunes its functionality to manifest the structural plasticity of dendritic spines.
Eunji Cho, Sang-Eun Lee, Unghwi Lee, Yuna Goh, Seonyoung Jeong, Junyoung Choi, Won-Ki Jeong & Sunghoe Chang
(Experimental & Molecular Medicine)
연구팀은 nArgBP2가 활성화되지 않은 신경세포 및 세포 외에서 액체-액체 상 분리 현상을 통해 액체방울 (액상 응집체)를 형성함을 발견하였고, 이러한 응집체는 고체 성질의 응집체가 아니고, 활발하게 외부 단백질과 교환되는 등 액상의 성질을 가진 것을 실시간 이미징과 생화학적 실험을 통하여 증명하였다.
즉, 신경 휴지 상태에서 nArgBP2는 액상 응집체 형성을 통하여 외부 단백질과 격리되어 있음을 발견하였다.
그러나 신경세포에 시냅스 장기강화를 유발하면, 이 nArgBP2 액상 응집체가 칼슘/칼모듈린 의존 단백질 인산화효소 (CaMKIIα)에 의해 분해되며, 이렇게 유리된 nArgBP2는 세포 내 액틴 세포골격 형성에 관여하는 다른 단백질과 상호작용함을 확인하였고, 더 나아가 nArgBP2와 이들 단백질의 상호작용이 시냅스 장기강화에 의한 신경 구조적 가소성에 필수적임을 증명하였다.
따라서 휴지 상태의 성숙한 신경 세포에서 nArgBP2는 상 분리된 액상 응집체 내에 격리되어 존재하다가 시냅스에 장기강화 자극이 주어지면 CaMKIIα에 의한 인산화로 풀리면서 다른 단백질과의 상호작용을 통해 수상돌기 가시의 구조적 가소성 (structural plasticity) 및 시냅스 신호전달을 조절함을 밝힘으로서, 성숙한 신경세포에서 nArgBP2의 기능이 신경세포 활성화 정도에 따라 조절되는 기전을 규명하였다.
본 연구는 액상 간 상 분리 현상을 통하여 신경기능을 조절할 수 있다는 직접적인 증거를 제시한 중요한 연구결과임과 더불어 nArgBP2 액상 응집체 형성 기전에 이상이 발생할 시 조울증 및 지적장애 질환의 원인 기전으로 작용할 수 있음을 제시한 연구이다.
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단 중견연구자 지원사업의 지원을 받아 수행된 연구로 ‘Experimental & Molecular Medicine (IF 12. 153)‘ 에 2023년 1월 4일 온라인 게재되었다.
[용어설명]
- ○일상생활에서 볼 수 있는 물과 기름이 서로 분리되어 두 액체상으로 공존하는 현상 등을 뜻하며, 최근 세포 내부의 다양한 생체분자들이 상 분리를 통해 여러 응집체를 이루는 것이 알려졌다.
- ○시냅스에서 보내어진 신경전달을 다른 신경 세포의 수상돌기를 통해 받는다. 수상돌기 가시는 신경 활성도에 따라 형태가 변화하며 이를 통해 시냅스의 구조와 기능 변화를 조절한다.
- ○시냅스에서 일어나는 신경전달이 장기간에 걸쳐 강화된 상태로 유지되는 현상을 의미하며, 학습과 기억 (learning and memory)의 신경생물학적 기전으로 알려져 있다.
- ○인산화된 단백질을 만드는 주요 효소로 특히 시냅스 장기강화를 유도하는 과정에서 중요한 역할을 한다.
- ○세포 내 골격 구조의 일종으로 세포 내 물질이동, 구조 변이에 역할을 한다. 신경 세포에서는 시냅스의 기능을 조절하는 구조로 특히 수상돌기 가시를 구성하는 주요 골격 구조이다.
[그림설명]
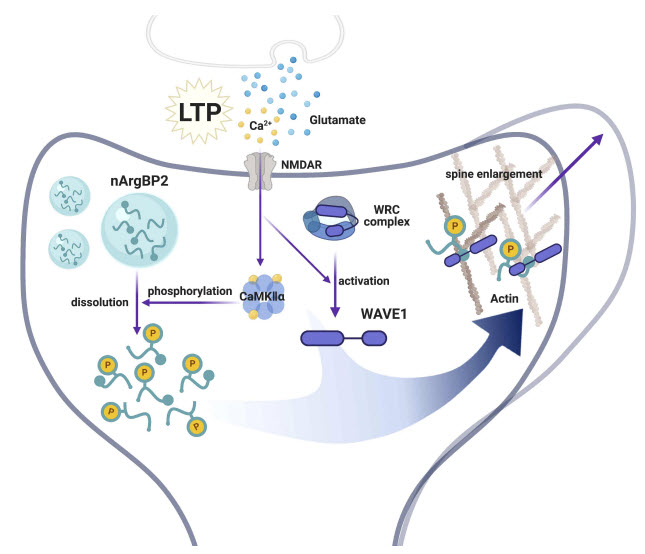
장기강화 자극 동안 일어나는 수상돌기 가시의 확대 모델에서 nArgBP2의 역할
휴식 상태의 nArgBP2는 성숙한 신경 세포에서 상 분리된 응축물로 존재하다가 시냅스에 장기강화 자극이 주어지면 응축물이 풀리면서 수상돌기 가시의 구조적 가소성 및 시냅스 신호전달을 조절한다.

