- TM4SF5-탑재 소포체를 통한 간-갈색지방조직 사이의 상호작용에 따른 혈중 포도당 조절 -
[연구필요성]
- -생체 내 혈중 포도당 (혈당) 항상성을 조절하기 위한 여러 장기 및 기관들 사이의 상호작용에 대해서는 잘 알려지지 않았음.
- -간세포에서 분비되는 소포체(엑소좀, exosome)가 혈액을 타고 어떤 장기 및 기관을 향해 이동하는지, 그리고 대사 과정과 관련해 어떤 역할을 수행하는지 밝혀지지 않았음.
- -간(liver)과 같이 대사적 기능이 활발한 특정적 장기에서 분비하는 소포체의 분리, 특성 및 기능 규명은 이루어진 바 없었음.
- -간상피세포(hepatocyte)에서 발현하는 TM4SF5 막단백질의 발현이 혈당 항상성 조절에 미치는 영향에 대회서는 알려진 바 없었음.
[연구성과/기대효과]
- -혈중 포도당 항상성을 조절하는 새로운 메커니즘을 제시함.
- -특정적으로 실험동물의 간세포/조직에서만 분비되는 TM4SF5-탑재된 엑소좀을 분리하였고, 이들을 추적하여 혈액을 통해 다른 기관, 특히 갈색지방조직(brown adipose tissue, BAT)으로 이동하는 것을 밝힘.
- -소포체를 타고 이동한 TM4SF5에 의해 갈색지방세포에서 혈중 포도당을 흡수를 향상시켜, 갈색지방세포 내에서 포도당을 이용한 에너지대사의 활성화를 유발함으로써, TM4SF5가 결여된 소포체가 이동된 경우보다, 포도당 소모가 커지도록 함을 확인함.
- -당뇨(diabetes) 등 많은 대사성 질환과 관련성이 큰 고혈당(hyperglycemia) 상태를 완화하는 새로운 치료법으로 TM4SF5-기반 엑소좀 엔지니어링 기술을 제시함.
[본문]
- ○본 연구팀은 세포 혹은 생쥐 실험동물 모델에서 간세포 유래 소포체(엑소좀)을 분리, 분석하는 기술을 개발함. 포도당 수준이 다른 환경에서 간세포 유래 소포체를 분리, 분석한 결과 소포체의 크기가 달라짐을 밝힘. TM4SF5 막단백질이 발현하는 간상피세포 혹은 실험동물의 간 조직에서 분리된 소포체가 작아지고, 다른 세포/장기를 표적할 수 있는 단백질들이 추가적으로 탑재될 수 있음을 확인함
- ○또한 간세포 혹은 간 조직으로부터 분리한 TM4SF5-탑재된 소포체에 형광 표지를 한 후 마우스에 주입하여 소포체의 생체 내 장기들로의 이동을 추적함.
- ○이러한 성과는 혈액 내 존재하는 소포체들 가운데 간세포 유래 소포체만을 분리할 수 있게 하였고, 간세포에서 분비되는 소포체를 추적하여 간과 다른 장기/기관 사이의 상호작용을 밝히는 데 이바지함.
- ○본 연구팀은 간상피세포 외부의 포도당 농도 향상에 따른 간상피세포로부터 유래된 TM4SF5-탑재 소포체의 분비가 유발됨을 확인함.
- ○혈중 인슐린의 수준과는 별개로, 간상피세포에 발현되는 TM4SF5는 포도당 수송체 type 1(GLUT1)과의 결합을 통해, 간상피세포 내부로의 포도당 흡수를 향상시킴. 한편, 간상피세포에서 유래된 TM4SF5가 탑재된 소포체의 분비가 유발됨.
- ○간상피세포에서 유래된 TM4SF5가 탑재된 소포체는 혈액을 통해 갈색지방조직으로 전달됨을 발견함. 소포체를 통해 갈색지방세포로 전해진 단백질 가운데 TM4SF5가 갈색지방세포의 세포막에 위치하여 포도당 수송체 type 4(GLUT4)와의 결합을 통해 세포 내부로 포도당 유입을 촉진함을 확인함. 이는 인슐린의 작용과는 별도의 현상으로 추정됨.
- ○TM4SF5가 탑재된 소포체의 이동 후, 갈색지방세포에서 열 발생을 통해 포도당을 소모함을 밝힘. 특히 TM4SF5-탑재 소포체의 갈색지방조직으로의 이동에 따른 동물의 체온 조절에 의미가 있음을 확인함.
- ○TM4SF5-탑재 소포체의 이동을 통한 간-갈색지방조직의 상호작용으로 인슐린의 작용과는 별도로 혈중 포도당 농도가 적절히 조절될 수 있음을 확인함
- ○TM4SF5 유전자 결여 및 과발현 유전자변형동물의 (2년 이상) 장기 사육을 통한 체중 및 생존율의 조사 분석을 수행함.
- ○TM4SF5-탑재 소포체의 이동을 통한 간-갈색지방조직의 상호작용에 따라, 실험동물들의 신진대사, 체중 조절, 및 생존율(수명) 등의 건강이 좋아질 수 있음이 연계 추정됨.
- ○이러한 연구성과는, 인슐린의 작용과는 별도로, TM4SF5-탑재 소포체 기반의 포도당 대사의 항상성을 조절할 수 있는 새로운 기전을 제시하는 것임. 또한, TM4SF5-탑재된 간유래 소포체 엔지니어링을 통해 대사성 질환을 완화하는 예방 및 치료법을 개발할 수 있을 것으로 기대됨.
[연구결과]
Liver-originated small extracellular vesicles with TM4SF5 target brown adipose tissue for homeostatic glucose clearance
Jae Woo Jung* Ji Eon Kim*, Eunmi Kim*, Hyejin Lee, Haesong Lee, Eun-Ae Shin, and Jung Weon Lee
(Journal of Extracellular Vesicles, DOI: 10.1002/jev2.12262)
포도당은 생체 내에서 가장 중요한 에너지 원천으로, 세포 내부에서 해당 과정을 통해 에너지를 생산하게 된다. 하지만 혈중 포도당 수준이 과도하게 높아지는 현상(hyperglycemia)은 당뇨, 암과 같은 여러 대사성 질환과 연관성이 깊게 있다. 체내 포도당의 농도를 조절하기 위해서 췌장에서 분비되는 인슐린에 의해 근육, 지방 등의 조직에서 포도당을 흡수하여 소비함이 알려져 있다. 포도당 대사의 조절과 항상성 유지를 위한 생체 내의 조절자로 새로이 TM4SF5 단백질이 실린 소포체(엑소좀)을 통한 메커니즘을 밝혔다. 간세포 막에 발현하는 TM4SF5 단백질은 세포 내부로의 포도당 유입을 촉진하여 포도당을 이용한 해당 과정을 통해 세포 내부의 에너지를 효율적으로 만들어낸다. 간상피세포 외부에 포도당이 과다하게 높아지면 TM4SF5는 소포체에 실려 혈액을 통해 갈색지방조직으로 이동하며, 혈액의 과도한 포도당을 갈색지방조직 세포 내로 흡수하여 열 발생 과정을 통해 소모함으로써, 체내 포도당 수준을 일정하게 유지하는 것을 밝혔다. 본 연구는 TM4SF5가 탑재된 소포제의 장기간 (간→갈색지방조직) 상호작용을 통한 포도당 항상성 조절을 위한 새로운 메커니즘을 제시하였고, 대사 질환을 극복하는 새로운 예방·치료법으로 TM4SF5-탑재 기반 소포체 엔지니어링을 제시했음.
본 연구 결과는 2022년 9월 5일에 세포생물학 관련 권위지인 Journal of Extracellular Vesicles (Impact factor, 17.335, 2021 JCR)에 온라인으로 게재되었으며, 과학기술정보통신부의 연구재단이 지원한 바이오·의료기술개발사업 및 (유형2) 중견연구의 지원을 받아 수행된 것임.
[용어설명]
- ○정상적 간상피세포에서 다소 발현하지만, 과다 염증의 상황에서는 발현이 과하게 높아져 여러 지방간, 지방간염, 간섬유화 및 간암 등의 간질환이 유발될 수 있음이 확인되었음.
- ○세포의 원형질막에 존재하면서 세포 외부 포도당을 세포 내로 수송하는 단백질임. 여러 가지 type들이 존재함.
- ○세포 내부에서 생성되어 외부로 방출되는 소낭(Extracellular Vesicles, EVs)의 일종으로 50~150 나노미터 크기의 소포체이다. 소포체는 단백질, 지질, 핵산 (miRNA, mRNA, DNA)을 포함하며, 다른 세포들과 융합하여 내용물을 전달할 수 있다.
- ○포도당(Glucose)을 피루브산(Pyruvate)으로 전환하는 대사 경로이다. 이 과정에서 고에너지 분자인 ATP, NADH를 형성한다.
- ○흰색지방조직 (White Adipose Tissue, WAT)과 달리, 지질 방울 (lipid droplet)이 크지 않고, 지방세포의 미토콘드리아 함유량이 많아 갈색으로 보이는 지방 조직이다. 풍부한 미토콘드리아를 이용한 열 발생(thermogenesis)이 많이 일어나 체온 유지를 하는 데 역할을 하고, 나머지 에너지 소비를 통한 대사 건강에 기여함이 알려져 있다.
[그림설명]
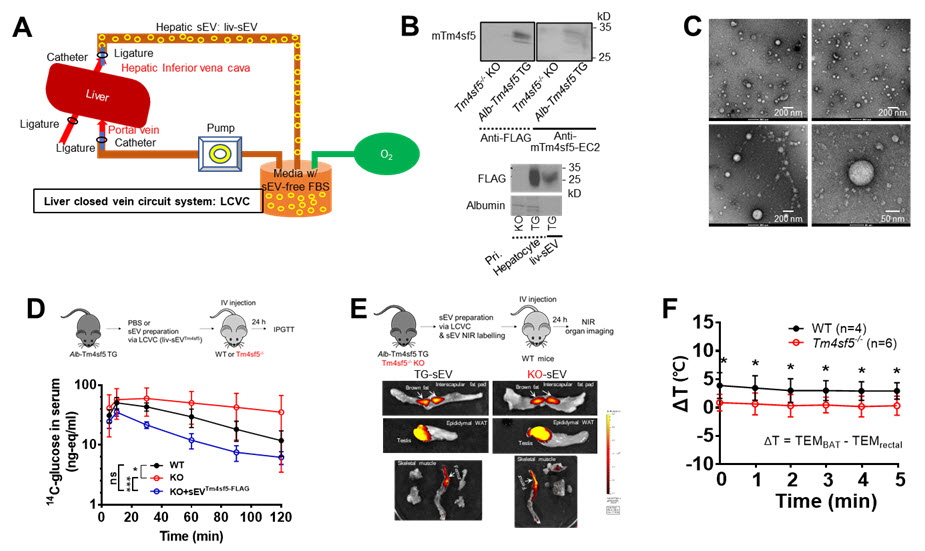
- (A)생쥐 실험동물의 간 조직으로부터 소포체(엑소좀)를 분리하기 위한 Liver-closed vein circuit system 그림
- (B)Liver-closed vein circuit system을 이용하여 생쥐의 간세포로부터 얻은 소포체에 존재하는 Tm4sf5의 탑재를 확인하는 단백질 면역블랏
- (C)Liver-closed vein circuit system을 이용하여 생쥐의 간세포로부터 얻은 소포체를 전자현미경으로 확인한 이미지
- (D)Tm4sf5를 과발현하도록 제작한 유전자변형동물(Alb-Tm4sf5 TG)로부터 얻은 간유래 소포체를 정상(WT) 혹은 Tm4sf5 유전자 결여 동물(KO)에게 정맥에 주사하고 난 후, 포도당을 체내에 투여하고 시간별로 혈액을 채취하여 혈중 포도당의 농도를 측정하여 혈당의 변화를 추적한 실험. KO 마우스보다 WT 마우스에서 시간에 따른 혈당의 감소가 돋보임. 더욱이, TG 마우스의 간유래 소포체를 주사한 WT 마우스의 경우, 혈당의 감소가 더욱더 두드러지게 감소함.
- (E)Alb-Tm4sf5 TG 혹은 Tm4sf5 유전자 결여 KO 마우스로부터 liver-closed vein circuit system을 이용하여 얻은 소포체에 근적외선 형광염료를 처리하여 표식한 후, 정상 마우스에 정맥에 주사하여 각 장기에 소포체의 존재 여부를 생체이미징 기법을 통해 확인한 그림. TG 마우스 간유래 소포체가 KO 마우스 간유래 소포체보다 갈색지방조직으로의 이동이 좀 더 강하게 보임.
- (F)정상(WT) 및 Tm4sf5 유전자 결여(KO) 마우스를 4℃에 3시간 방치 후, 실온으로 옮긴 후 1분마다 5번을 각 동물의 체온을 측정한 결과임. 각 마우스의 체온은 항문 체온과 등부위 갈색지방조직에의 체온을 동시에 측정하여 그 차잇값(= 갈색지방조직 체온-항문 체온)을 그래프로 표현한 것임. 즉, Tm4sf5 유전자가 결여된 마우스에는 간유래-Tm4sf5를 포함하는 소포체의 역할이 없는 경우로서, Tm4sf5-기반 소포체가 존재하는 정상 마우스에 대비하여 체온이 낮음. 이는 Tm4sf5가 탑재된 소포체가 정상 마우스에서는 간으로부터 분비되어 갈색지방조직으로 이동하여 갈색지방세포의 혈중 포도당 흡수 및 소모를 통한 열 생성의 기전으로 혈당 조절 및 체온 조절이 되는 것으로 추정 가능하였음.

