유전자 조절은 질병치료뿐 아니라 최근 백신/어쥬번트 개발에도 효율적이라는 것이 알려지면서 선천적, 후천적 질병 치료 및 다양한 백신 개발을 하는 연구와 관련 기업에 많은 각광을 받고 있다. 초기 바이러스 전달체를 활용한 유전자 치료법이 연구되면서 감염 가능성 및/또는 원하지 않는 염증 유발 등의 안전성 문제가 개선되고 있지만, 개발 및 제조 공정이 복잡해서 최근에는 안전성이 높은 비바이러스 전달체들이 관심을 받고 있다. 그러나 비바이러스 전달체가 체내에 주입되면 다양한 효소분해, 면역세포에 의한 제거, 비특이적 세포 결합 등의 장벽을 극복해야 하고, 전달된 유전자가 표적세포에 들어가더라도 독성 및 라이소좀(lysosome)에 의한 유전자 분해 등의 문제로 낮은 유전자 발현 효율이 발생한다.
서울대학교 농생명공학부 윤철희/조종수 교수 연구팀은 비바이러스 전달체의 단점을 극복하고 표적 세포 내에서의 독성 감소, 엔도좀에서의 전달물질(유전자 및 백신후보) 탈출, 라이소좀 안에서 타깃물질 분해 억제 등의 해결책으로 비바이러스 전달체의 일종인 고분자 전달체 개발을 해오고 있다. 그 결과 세포 내 장벽을 극복하기 위한 새로운 전략으로 엔도사이토시스(endocytosis) 기전 조절이 세포 내 도입 물질(유전자, 단백질)의 운명을 좌우한다는 사실을 밝혔다. 카비올레이(caveolae) 엔도사이토시스 기전은 전달된 물질이 라이소좀 소포와 융합되지 않기 때문에 도입된 유전자 또는 백신후보물질이 라이소좀 안에 있는 효소에 의해 분해되지 않은 상태로 사이토졸로 이동된다. 연구된 고분자 전달체는 카비올레이 기전을 촉진하는 방법의 하나인 삼투압 특성을 갖는 프리폴리머(prepolymer)와 엔도좀 탈출을 돕는 세포독성이 적은 저 분자량의 폴리에칠렌 이민과의 공중 합체의 물질이다.
본 리뷰 논문에서는 그동안 얻어진 연구결과를 바탕으로 엔도사이토시스 기전에 영향을 미치는 고분자 전달체의 물리화학적 특성과 세포 내 기전 및 상호작용을 정리하여 재료분야 최고학술지인 Progress in Materials Science (2022 impact factor: 48.165)에 2022년 6월 논문을 발표하였다 (논문 제목: Essential cues of engineered polymeric materials regulating gene transfer pathways).
본 연구진은 전 세계적으로 고분자 전달체/유전자 복합체의 엔도사이토시스가 선택적으로 카비올레이 매개에 의해 세포내복합체의 라이소좀 분해 회피로 유전자/단백질의 전달 효율이 현저히 향상됨을 발표하였다.
[연구결과]
Essential cues of engineered polymeric materials regulating gene transfer pathways
Mohammad Ariful Islam, Tae-Eun Park, Jannatul Firdous, Hui-Shan Li, Zuly jimenez, Michael Lim, Jeong-Won Choi, Cheol-Heui Yun*, Chong-Su Cho* [equal contribution as corresponding author]
Progress in Materials Science, 2022, 6
유전자 물질 전달기술은 질병의 원인이 되는 유전자를 삭제 및 교환하여 선천적이나 후천적 질환을 치료할 수 있을 뿐만 아니라 바이러스의 정보를 세포 내로 전달하여 RNA & DNA 바이러스 등의 예방을 위한 백신 개발 등 널리 사용할 수 있으며, 따라서 최근 많은 각광을 받고 있다. 바이러스 전달체를 활용한 백신 또는 유전자 전달은 면역 원성, 감염 문제, 염증 유발 등의 문제점이 있었으나 최근 이러한 한계점을 극복하고 몇 개의 바이러스 전달체가 코로나바이러스 백신 임상에 적용되고 있다.
그러나 아직도 안전성 문제와 복잡한 제조공정으로 좀 더 안전성이 높고, 쉬운 생산성, 낮은 가격을 갖는 비바이러스 전달체들에 관심이 쏠리고 있다. 하지만 비바이러스 전달체들은 독성이 거의 없어서 단점으로 지적되는 유전자 발현 효율을 높이는 연구가 활발히 진행되고 있다. 비바이러스 전달체 중 리피드, 카본, 실리카, 금 및 고분자 기반의 전달체들은 각각의 장단점을 가지고 있다. 특히 독성이 적은 생분해성 고분자 전달체는 쉽게 유전자나 백신 및/또는 어쥬번트와 결합하여 안정적인 나노입자를 형성하고 독성이 적다는 장점이 있다.
그러나 고분자 전달체가 체내에 주입 후 표적세포까지 도달하기까지 전달된 유전자가 혈액에 의한 분해, 면역세포에 의한 포획, 비특이적 세포와의 결합 등의 세포 외 장벽을 극복해야 한다. 비록 세포의 장벽을 극복 후 전달된 유전자가 표적세포에 들어가더라도 엔도좀(endosome) 탈출 및 라이소좀(lysosome)에 의한 유전자 분해가 발생이 되지 않도록 고분자 전달체의 세포 내 유입을 조절하는 전략이 높은 유전자 발현에 필수적이다. 본 논문에서는 유전자 전달 통로를 조절하는 고분자 물질의 설계에 대하여 아래와 같이 설명하였다.
1) 세포 내 도입된 물질의 엔도좀 탈출을 위해 완충작용과 독성이 낮은 분해성 폴리에틸렌이민(polyethylenimine)과 라이소좀 안에서 생분해가 되지 않는 삼투압 특성을 갖는 예비중합체와 결합한 새로운 고분자를 합성하였다.
2) 표적세포 내로 외부물질이 도입되는 경로는 효소분해가 일어나는 경로인 phagocytosis, macropinocytosis, clathrin-dependent endocytosis가 있고, 반면에 이러한 분해가 일어나지 않는 caveolae-mediated endocytosis가 있는데 각각의 기전 및 장단점을 설명하였다.
3) 고분자 화학구조, 분자량, 분해성, 조성, 소수성, 분자 배치에 따른 endocytosis 경로에 미치는 영향을 설명하였다.
4) 물리적 요인인 삼투압, 나노입자의 강직성, 전단력, 초음파, 입체구조, 나노입자 형태에 따른 endocytosis 경로에 미치는 영향을 설명하였다.
5) 나노입자의 표면전하 및 pH 민감성, 세포투과성 펩타이드에 따른 endocytosis 경로에 미치는 영향을 설명하였다.
6) 세포 외 기질, 세포 종류, 세포 극성, 배위자, 세포질 및 핵 진입에 따른 endocytosis 경로에 미치는 영향을 설명하였다.
7) 최근 각광받는 genome editing에 사용되는 CRISPR-Cas 계에 고분자 전달체 사용에 따른 유전자 치료 가능성을 언급하였다.
결론적으로 세포 내 장벽을 극복하기 위한 새로운 전략 중 endocytosis 기전에서 카비올레 endocytosis 기전은 표적 물질이 삼투압을 갖는 고분자 전달체에 의해 라이소좀 안에서 분해되지 않고 엔도좀에서 완충작용으로 쉽게 탈출하기 때문에 뛰어난 유전자 발현 및 전달 효율이 높아진다는 것을 세계적으로 처음 확인한 결과로서 장래에 다양한 뉴클레오타이드나 백신 및/또는 어쥬번트 전달체로써 활용할 수 있을 것이다.
[용어설명]
- ○Endocytosis는 세포 내 이입으로 세포 밖의 물질이 세포 내로 유입되는 과정으로 형질막을 통해 물질을 끌어들이고 융합하는 과정을 통해 일어난다.
- ○삼투압을 갖는 고분자로 고분자의 구조에서 친수성을 갖는 많은 hydroxyl group이 주변의 수분때문에 삼투압이 발생하는 고분자를 칭한다.
- ○중합체에서 다시 새로운 중합체를 형성할 수 있는 중합체를 일컫는다.
[그림설명]
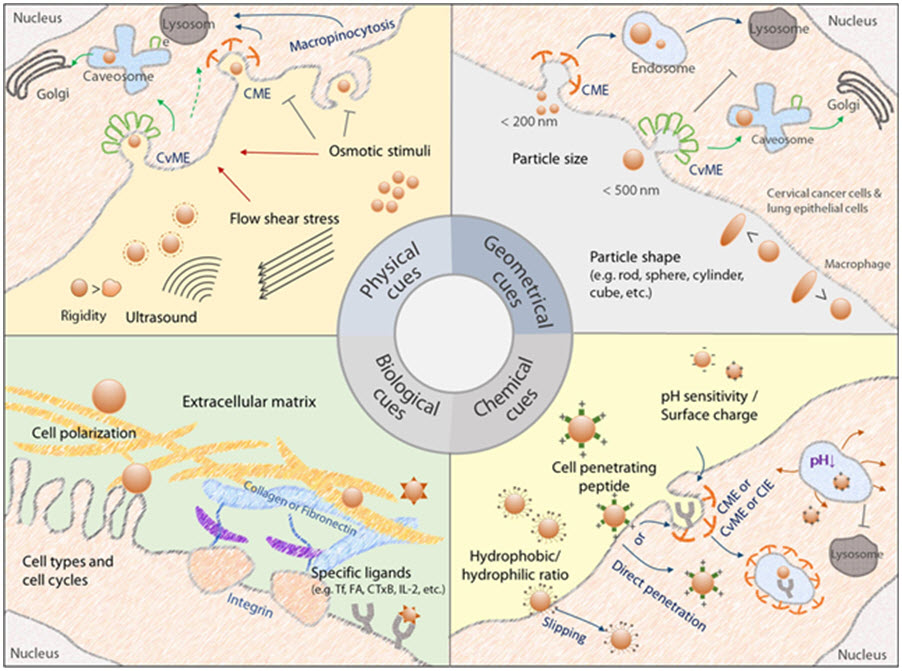
고분자 유전자 전달체의 세포 내 진입과 endocytosis 기전 조절에 영향을 주는 요소의 모식도
본 모식도는 고분자 전달체의 세포 내 진입과 endocytosis 기전 조절에 영향을 주는 요소들을 모식화 한 그림으로 물리적 요인으로 삼투압, 전단력, 초음파 및 나노입자의 강직성, 입체구조적 요인으로 나노입자의 형태 및 크기, 화학적 요인으로 표면전하, pH 민감성, 세포투과 펩타이드 및 소수성, 생물학적 요인으로 세포 외 기질, 세포종류 및 세포 극성이 endocytosis 기전 조절에 영향을 주고 있다.

