- 인간 막 단백질들이 새로운 기능과 구조형성 능력 간의 균형을 맞추며 진화해 왔음을 밝혀 -
[연구필요성]
세포 내에서 일어나는 여러 현상은 막으로 구분되어 있으며, 이러한 막에 존재하는 막 단백질들은 유무형의 정보를 수송하는 매우 중요한 역할을 한다. 이러한 단백질이 제대로 기능을 하기 위해서는 올바른 접힘 과정을 통해 3차원 구조가 형성되어야 한다. 그런데 구조가 형성되고 해당 구조에 대한 연구는 많이 진행되고 있지만 그러한 구조가 어떻게 만들어지는지에 대한 연구는 부족하다.
특히 막 단백질의 접힘 과정은 실험적 접근성의 한계로 그 중요성에 비해 밝혀진 바가 매우 적다. 이러한 막 단백질에 세밀하게 힘을 전달할 수 있는 자기 집게 기술을 이용하면 실험적 한계를 극복하고 단백질의 접힘 과정을 살펴볼 수 있다. 복잡한 당 수송 단백질의 접힘 경로에 대한 연구를 통해 막 단백질의 기본 원리에 대한 탐구가 가능해질 것이다.
[연구성과/기대효과]
자기집게 기술을 이용하여 최초로 복잡한 막 단백질인 포도당 수송체 단백질의 접힘 과정을 규명하였다. 특히 소포체막 단백질 복합체(EMC)와 특이구조를 지닌 지질분자를 이용하여 생리학적인 환경에서 막 단백질의 구조 형성 과정을 완전히 밝혀내었다. 그리고 생물정보학을 이용하여 다양한 당 수송 단백질의 서열을 분석하였다. 이를 통해 단백질의 구조형성 능력과 새로운 수송 기능이 균형을 맞추며 진화해 왔음을 발견하였다. 이후 더욱 다양한 막 단백질에 자기 집게 기술을 적용하여 막 단백질에서 관찰되는 일반적인 원리에 대해 규명할 수 있을 것으로 기대한다.
[본문]
서울대학교 생명과학부 윤태영 교수 연구팀은 세계 최초로 포도당 수송체 단백질의 접힘 과정을 규명하였고, 이로부터 막 단백질들의 공통된 진화원리를 발견하였다. 이번 연구는 과학기술정보통신부 산하 리더연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행되었다. 서울대학교 생명과학부 윤태영 교수 연구팀이 본 연구를 주도하였으며, 다양한 분야의 연구팀들과 다학제적 연구를 수행하였다 (서울대학교 생명과학부: 최희정 교수, Martin Steinegger 교수, 노성훈 교수; MRC laboratory at Cambridge: Elizabeth A. Miller 교수; Lehigh University: Wonpil Im 교수; Michigan State University: Heedeok Hong 교수).
최근 저온 전자현미경 등과 같은 구조생물학 분야 기술들의 발전으로 포도당 수송체 단백질을 포함한 많은 막 단백질의 구조가 밝혀졌지만, 이러한 막 단백질의 구조가 형성되는 접힘경로는 여전히 거의 전혀 알려지지 않은 채로 남아있다.
본 연구팀은 자기집게 기술을 이용하여 막 단백질들의 접힘경로를 밝힐 수 있음을 2019년에 Science지에 보고하였으며, 이번 연구에서는 본 연구팀의 고유한 기술을 더욱 발전시켜 가장 복잡한 막 단백질 중 하나인 포도당 수송체 단백질의 접힘경로를 최초로 밝혀냈다.
자기 집게 기술을 이용하면 단일 단백질에 힘을 가할 수 있으며 이를 통해 단백질의 구조를 완전히 풀어낼 수 있다. 또한 해당 단백질에 가한 힘을 낮추면 풀어진 단백질이 다시 원래의 구조로 접히는 과정을 관측할 수 있다 (그림 1). 이러한 과정을 통하여 포도당 수송체 단백질의 접힘 및 풀림 경로를 밝혀내었다 (그림 2).
포도당 수송 단백질은 그 이름에서 알 수 있듯이, 포도당이 지나갈 수 있는 통로를 그 구조 안에 가지고 있는 단백질이다. 이러한 포도당 수송 통로는 기능적으로 반드시 필요하지만, 반면 막 단백질이 3차원 구조를 형성함에 있어서는 난관으로 작용하게 된다. 이러한 어려움을 해결하기 위해 세포들은 다양한 도우미들을 이용하게 되는데, 본 연구에서는 셰피론의 일종인 소포체막 단백질 복합체(EMC)와 독특한 형태를 갖는 지질분자들이 포도당 수송체 단백질의 구조형성을 돕는다는 것을 밝혀내었다.
특히 포도당 수송체 단백질들이 N-말단부터 절반에 해당하는 도메인이 이후의 C-말단 도메인에 비해 구조형성에도 뛰어나고 형성된 구조도 더 안정한 것을 확인하였다. 나아가 생물정보학을 통해 포도당 수송체 단백질에서 발견된 특징이 모든 후생동물의 당 수송체 단백질에서 보존되어 있는 것을 발견하였다 (그림 3). 이를 통해 세포가 보다 기능적으로 뛰어난 막 단백질들을 형성하기 위해, 그 구조형성 능력을 일정 부분 희생한 후 이를 기능성이 뛰어난 셰피론이나 특이구조의 지질분자들을 개발함으로써 그 균형을 맞추어 왔다는 것을 발견하였다.
[연구결과]
Evolutionary balance between foldability and functionality of a glucose transporter
Hyun-Kyu Choi, Hyunook Kang, Chanwoo Lee, Hyun Gyu Kim, Ben P. Phillips, Soohyung Park, Charlotte Tumescheit, Sang Ah Kim, Hansol Lee, Soung-Hun Roh, Heedeok Hong, Martin Steinegger, Wonpil Im, Elizabeth A. Miller, Hee-Jung Choi and Tae-Young Yoon
(Nature Chemical Biology, online publication)
단분자 자기집게 기술을 이용하여 포도당 수송체 단백질(GLUT3)의 완전한 접힘 경로를 밝혀내고 당 수송 단백질 진화 원리를 발견하였다. 이를 간략히 정리하면 우선 GLUT3는 N,C-도메인이라는 2개의 큰 부분으로 구성되어 있다. 이 중 N-도메인이 먼저 접힘으로써 단백질의 구조형성 능력을 확보한다. 다음으로 이러한 N-도메인을 기반으로 하여 대부분의 포도당 결합 부위를 가진 C-도메인이 구조를 형성한다. 그리고 N, C-도메인 각각의 세부적인 접힘 경로를 밝혀내었다. 또한 복잡한 구조로 인해 막 단백질은 자체적으로 온전히 구조가 형성되기 힘들다. 이를 도와주기 위해 소포체막 단백질 복합체(EMC)라는 셰피론을 이용하였다. EMC를 이용하여 GLUT3가 구조가 원활히 형성되는 것을 확인하였다. GLUT3에는 N,C-도메인 사이에 수송 역할을 담당하는 통로가 있다. 이러한 통로는 당 수송을 위해 친수성을 띄는데 이러한 기능성으로 인해 구조 형성이 어려워진다. 이를 극복하기 위해 특이구조를 지닌 지질분자를 이용하였다. 이 지질분자의 도움으로 N,C-도메인이 완전히 결합하면서 GLUT3의 완전한 접힘 경로를 밝혀낼 수 있었다. 또한 생물정보학을 이용하여 이러한 특징이 많은 후생동물 수송체 단백질에서 발견됨을 확인하였다. 그 결과, 다양한 막 단백질이 구조를 형성하는 과정에서 구조형성 능력과 새로운 기능 사이의 균형을 맞추며 진화한다는 사실을 발견하였다.
[용어설명]
- ○세포막과 같은 생물학적 막에 존재하는 막 단백질(membrane protein)의 일종이다. 주로 소수성을 지닌 나선 단백질이 12개가 모여 형성되며 크게 2개의 도메인으로 구분된다. 이러한 2개의 도메인 사이에는 해당 단백질이 기능을 할 수 있도록 당이 지나갈 수 있는 통로가 있으며 친수성을 지닌다. 이러한 구조적인 특징은 다양한 후생생물의 당 수송 단백질에서 보존된다.
- ○1개의 단백질에 미세한 힘을 가할 수 있는 기술이다. 그 과정을 설명하자면 우선 자성을 띄는 구슬(자기구슬)을 단백질에 연결하고 이 단백질을 표면에 고정한다. 그 다음 영구자석을 가까이 가져가면 자기구슬이 자기력에 의해 영구자석 방향으로 움직이며 이에 연결된 단백질에는 장력이 가해진다 (그림 1). pN (10-12N) 단위의 미세한 힘을 가할 수 있으며 이에 따른 단백질의 실시간 길이 변화를 1nm (10-9m) 단위로 측정할 수 있다.
- ○단백질이 본래의 역할을 하기 위해서는 온전한 구조를 형성해야 한다. 그리고 이러한 구조가 만들어지기 위해서는 올바른 접힘 과정이 필수적이다. 그러나 이러한 과정은 단백질 자체적으로 일어나기에는 어려움이 있다. 이를 돕기 위한 단백질이 따로 존재하며 이를 셰피론(chaperone) 이라고 한다. 이러한 샤페론의 일종으로 소포체막 단백질 복합체이 있으며 막 단백질의 접힘 과정을 유도하여 막 단백질이 온전한 구조를 형성하도록 돕는다고 알려져 있다.
- ○세포 내에는 다양한 기능이 있으며 이러한 역할들이 막으로 구분되어 있다. 그리고 이 막을 구성하는 주요 물질이 지질분자이다. 세포 내의 막은 다양한 지질분자로 구성되어 있으며 지질분자의 분포에 따라 기능 및 모양이 다르다. 그중 PE 지질분자는 보통의 지질분자와 다른 구조로 되어 있다. 인지질은 머리 부분과 꼬리 부분으로 나뉘는데 PE 지질은 특이하게 머리 부분이 다른 지질에 비해 작은 특징을 지니고 있다.
[그림설명]
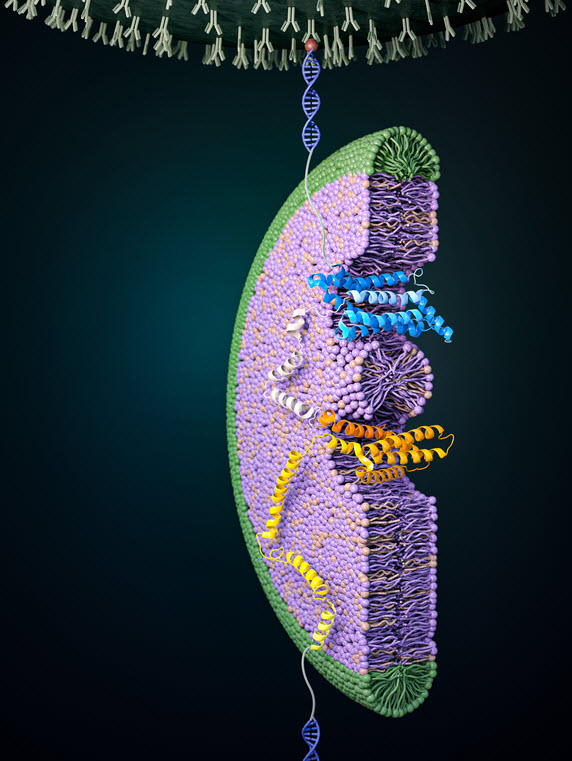
그림 1 당 수송 단백질의 접힘 과정
그림은 자기집게 기술을 이용하여 당 수송 단백질이 접히는 과정을 관찰한 것을 나타낸 모식도이다. 높은 힘을 가하여 단백질을 모두 풀어낸 다음 힘을 낮추게 되면 단백질이 접혀 구조를 형성하는 것을 관찰할 수 있다. 그림에서는 일부분이 접히면서 구조를 형성하여 바이셀 내부로 들어간 것을 확인할 수 있다. 이러한 접힘 과정은 당 수송 단백질 자체적으로 일어나기는 힘들며 주변의 막 환경과 EMC와 같은 단백질 복합체의 도움을 받아 이루어진다.
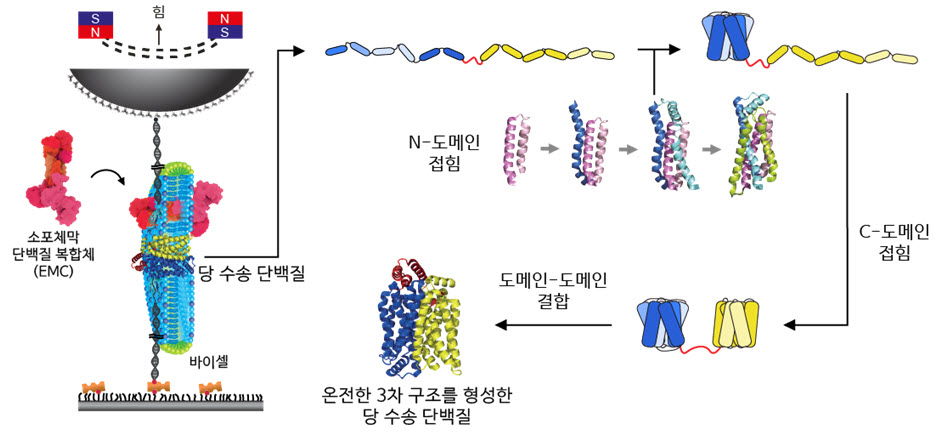
그림 2 자기 집게 기술 모식도와 당 수송 단백질의 접힘 경로
자기 집게 기술과 당 수송 단백질의 접힘 경로를 간략히 표시한 그림이다. 당 수송 단백질에 필요한 막 환경을 제공하기 위해 다양한 지질분자로 구성된 바이셀을 공급하였다. 또한 단백질의 올바른 3차 구조 형성을 도와주기 위해 소포체막 단백질 복합체(EMC)를 추가하였다. 자성을 띄는 구슬이 영구 자석이 있는 방향으로 올라가면 단백질에 연결된 줄(DNA)에 장력이 가해져 단백질이 힘을 받게 된다. 이러한 실험을 통해 오른쪽의 그림과 같이 당 수송 단백질의 접힘 경로를 밝혀내었다. 개개의 나선 단백질로 풀린 상태에서 우선 N-말단에 가까운 N-도메인이 접혀 구조형성 능력을 확보한다. 그리고 EMC와 특이구조를 지닌 지질분자의 도움을 받아 C-domain이 접히고 마지막으로 2개의 domain이 결합하여 기능을 가진 3차 구조를 형성하게 된다.
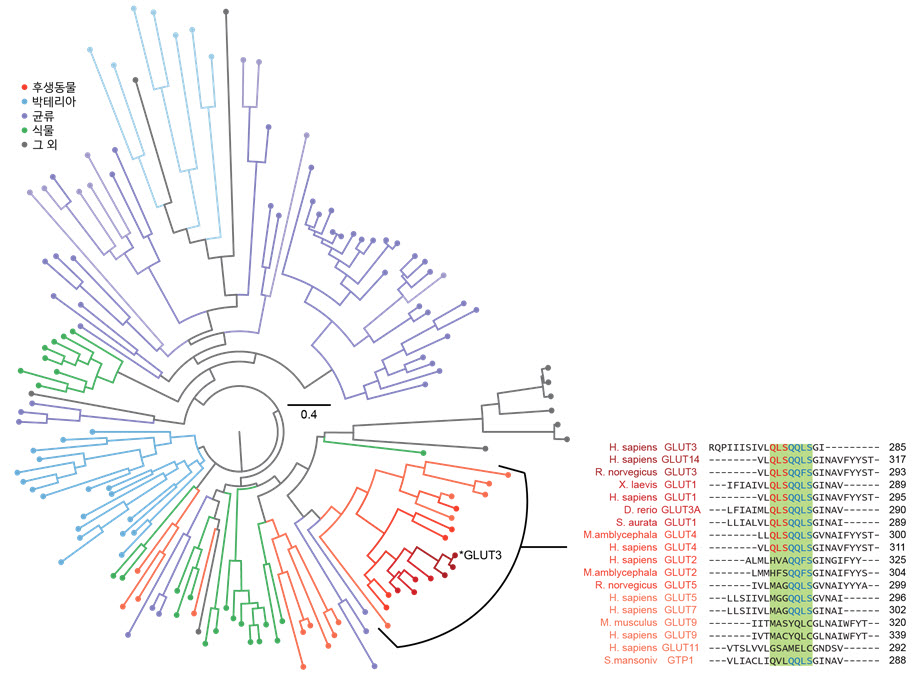
그림 3 생물정보학을 이용한 다양한 당 수송 단백질 분석
생물정보학을 이용하여 GLUT3뿐만 아니라 진화적으로 관련된 다양한 당 수송 단백질의 서열을 분석하였다. 총 143개의 단백질을 분석하였으며 이를 왼쪽 그림과 같이 계통수(Phylogenetic tree)로 나타내었다. 그리고 인간이 포함되어 있는 후생생물의 당 수송 단백질 서열을 오른쪽 그림고 같이 면밀히 분석하였다. 그리고 이를 자기 집게 기술을 통해 얻은 접힘 경로에 대한 정보와 결합하여 단백질의 구조형성 능력과 당을 수송하는 기능성이 진화적으로 균형을 맞추어 발전해왔음을 밝혀내었다.

