- 면역세포 내 신호전달 조절자로서 아연의 역할 -
서울대학교 의과대학 이원우 교수(미생물학교실/의과학과) 연구팀은 체내 필수 미량 금속 중 하나인 아연이 사람 단핵구/대식세포에서 염증반응을 강화하는 기전을 규명하였고, 이를 통해 류마티스 관절염과 같은 만성염증질환 환자의 면역반응 제어를 위한 새로운 가능성을 제시했다.
류마티스 관절염은 만성염증을 동반하는 대표적 자가면역질환 중 하나로, 전 세계의 0.5 ~ 2%의 인구가 본 질환으로 고통받고 있다. 관절 및 전신의 염증반응으로 인해 관절 부위에 통증 및 부종을 동반하는데, 본 질환의 발병기전에서 자가면역성 T, B세포뿐 아니라 단핵구 및 대식세포의 선천 면역반응도 중요한 역할을 하므로 주요한 치료타깃으로 알려져 있다.
면역반응을 위하여 면역세포는 지속해서 환경변화를 감지하고 의사소통하는 것이 필수적이다. 이러한 현상은 주로 세포막 수용체/리간드 연구로 설명됐으며, 실제 영양소, 대사산물, 무기이온을 이동시켜 직접 소통을 매개하는 용질운반 막 수송체(SLC: SoLute Carrier)의 역할에 대해서는 알려진 바가 많지 않았다.
류마티스 관절염 환자의 활성화된 말초혈액 단핵구는 다양한 SLC 수송체를 발현했는데, 본 연구에서는 특히 아연이온을 세포 내로 유입시키는 수송체인 SLC39A8 (Zip8: zinc importer protein 8) 발현이 매우 증가하여 있음을 관찰하였다.
본 연구팀은 활성화 단핵구/대식세포에서 Zip8에 의해 유입된 세포 내 아연이온에 의한 면역 대사 리프로그램과 신호전달계의 상호조절 기전 및 류마티스 관절염 병증과의 연관성을 규명하였다.
아연(Zinc)은 필수 미량 금속 중 하나로 면역계를 포함하여 체내 다양한 생물학적 과정에서 중요한 역할을 담당한다. 전통적으로는 단백질 구조 유지와 기능조절에 관여하는 보조인자(cofactor)로 알려졌지만, 최근에는 칼슘처럼 세포 내 신호전달 과정의 조절자로 작용함이 새롭게 알려졌다.
활성화 단핵구/대식세포의 Zip8을 통해 유입된 아연이온에 의해 세포 내 해당작용을 강화시키는 대사리프로그래밍이 유발되고 염증성사이토카인 IL-1β의 분비가 증가되었다. 이러한 해당작용 리프로그래밍에는 mTORC1/S6K 경로가 관여했는데 세포 내로 유입된 아연이온이 protein phosphatase 2A (PPA2) 활성을 억제하여 PP2A의 타깃인 S6K 인산화를 유지해주기 때문임을 증명하였다.
본 연구팀은 류마티스 관절염 환자의 단핵구에서 Zip8으로 유입된 아연이온에 의한 면역대사 리프로그래밍을 확인하였고, 환자의 임상증상(clinical parameter)과도 양의 상관관계가 있음을 밝혔다. 이러한 결과는 류마티스 관절염 환자를 포함하는 다양한 만성 염증성질환 환자의 면역제어 전략 개발에 활용될 수 있음을 시사한다.
이번 연구는 한국연구재단(중견연구자 지원사업)의 지원으로 수행되었으며 국제학술지‘Science Signaling’에 1월 11일 (화) 게재되었다.
논문명 : Cytoplasmic zinc promotes IL-1β production by monocytes and macrophages through mTORC1-induced glycolysis in rheumatoid arthritis
[연구결과]
Cytoplasmic zinc promotes IL-1β production by monocytes and macrophages through mTORC1-induced glycolysis in rheumatoid arthritis
Bonah Kim, Hee Young Kim, Bo Ruem Yoon, Jina Yeo, Ji In Jung, Kyung-Sang Yu, Hyeon Chang Kim, Su-Jin Yoo, Jin Kyun Park, Seong Wook Kang, Won-Woo Lee.
(Science Signaling. 2022 Jan 11;15(716):eabi7400)
아연(Zinc)은 필수 미량 금속 중 하나로 면역계를 포함하여 체내 다양한 생물학적 과정에서 중요한 역할을 한다. 아연결핍은 전반적인 면역 기능 저하를 일으키고 결과적으로 감염에 대한 감수성(susceptibility)을 증가시키기 때문에, 최근 면역시스템에서 아연의 역할에 관한 관심이 높아지고 있다. 기존에 알려진 아연의 역할은 수천 개 단백질의 구조 및 기능에 연관된 보조인자로서 작동하는 것이지만, 최근에는 칼슘처럼 세포 내 신호전달 과정의 조절자로서 새롭게 인식되고 있다. 본 연구에서는, 활성화된 사람 단핵구 및 대식세포 내로 유입된 아연이 염증반응에 매우 중요한 해당과정을 유도하는 신호 전달계인 mTORC1/S6K를 활성화하여 IL-1β 생성을 촉진하는 분자생화학적 기전을 증명하였고 이를 통해 아연이온이 염증반응에 매우 중요한 요소로 작동함을 밝히고 있다.
세포 내 아연농도는 세포 외 아연농도에 의해 영향받으며 이때 아연의 유입은 아연 특이적 수송체 Zip8을 통해 이루어짐을 확인하였다. 14개의 Zip 단백질이 존재하지만, 활성화 단핵구/대식세포에서는 Zip8 발현이 특이적으로 증가하였다. Zip8을 통해 세포 내로 유입된 아연이온은 S6 Kinase (S6K)의 인산화를 저해하는 Protein Phosphatase 2A (PP2A)의 활성을 억제하였으며 이는 mTORC1/S6K 경로 및 해당작용을 활성화하여, 결과적으로 염증성사이토카인인 IL-1β 생성을 증가시켰다.
만성염증질환인 류마티스 관절염(RA: Rheumatoid arthritis) 환자의 단핵구에서 건강 대조군의 단핵구에 비하여 Zip8과 metallothionein 2A(아연 결합 단백질) 발현, 그리고 S6K의 인산화가 증가하였다. 더욱이 RA 환자 단핵구에서 증가된 Zip8 발현 정도는 임상 증상(clinical parameter)과 양의 상관관계를 보였고, 이는 Zip8에 의해 증가한 아연유입이 염증반응을 강화한다는 점을 확인할 수 있었다. 본 연구의 결과는 단핵구/대식세포 염증반응에 필수적인 “면역대사 리프로그래밍”의 조절자라는 새로운 아연의 역할을 밝혔고 기존에 보고되지 않았던 면역대사학의 새로운 조절 기전을 제시하고 있다.
[용어설명]
- ○류마티스 관절염은 전신성 자가면역질환 중 하나로 주로 관절 부위, 특히 관절을 둘러싸고 있는 조직인 활막에 염증이 나타나는 만성염증성 질환이다.
- ○면역세포에 의해 생성되어 분비되는 작은 크기의 단백질로서, 세포 사이의 소통에 관여하여 다양한 면역반응을 매개한다. 면역세포의 활성화, 증식, 분화뿐만 아니라 성숙에도 영향을 준다.
- ○그람음성 세균(gram-negative bacteria)의 외막의 주요 구성 성분으로, 선천 면역세포의 강력한 자극원이다.
- ○세포막에 주로 발현하는 단백질로서 14개의 Zip (SLC39A; Zrt- and Irt-like protein; 아연 유입 수송체)와 10개의 ZnT (SLC30A; zinc transporter; 아연 방출 수송체)로 구성되어 있으며 세포 및 조직 특이적으로 발현한다.
- ○가수분해 효소의 하나로 자신의 기질인 인산 에스테르 및 폴리인산의 가수분해를 촉매하는 효소의 총칭이며, 탈인산 가수분해 효소라고도 한다. 즉, 기질에 존재하는 인산기를 제거하는 반응을 촉매하는 효소이다.
- ○포도당(C6H12O6, glucose)이 분해되어 2분자의 피루브산(CH3COCOO−, pyruvic acid)으로 전환되는 대사 경로이다. 이 과정에서 고에너지분자인 ATP 2분자와 NADH 2분자가 만들어진다.
[그림설명]
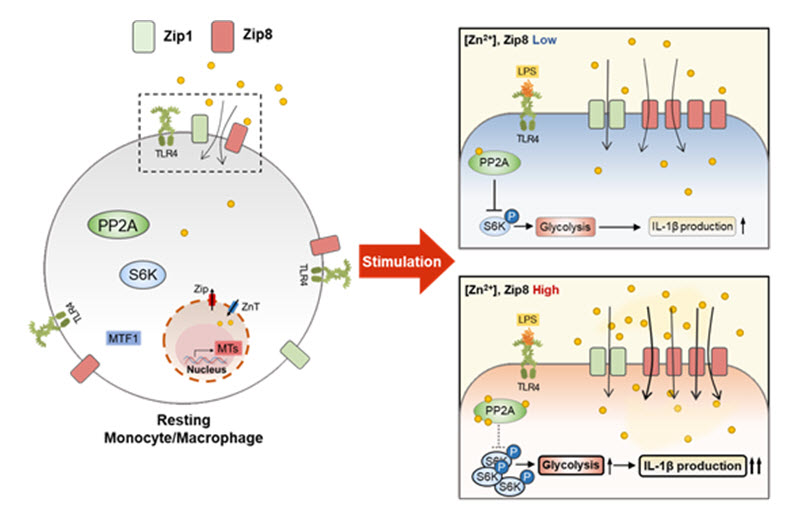
활성화된 사람 단핵구에서 관찰되는 Zip8 발현 증가와 이로 인해 유입이 증가한 아연의 염증반응 강화 기전
활성화된 단핵구 및 대식세포에서 아연 유입 수송체의 발현을 관찰한 결과, 14개의 Zip family(아연 유입 수송체; SLC39A) 중 Zip8 발현이 특징적으로 증가하였다. Zip8을 통해 유입된 세포 내 아연은 phosphatase 활성을 저해하여 해당과정으로의 대사리프로그래밍를 유도하는 mTORC1/S6K 신호전달 과정을 강화하고 그 결과 염증성사이토카인인 IL-1β 생산이 증가하였다. 본 연구 결과는 대표적 만성 염증질환인 ‘류마티스 관절염’환자의 단핵구에서 관찰되었으며 이는 세포 내 아연이온이 단핵구 및 대식세포에서 신호전달 조절자로서 염증반응에 관여한다는 것을 확인할 수 있었다.

