- 마이크로바이옴 대사체가 생체의 면역발달에 미치는 영향 규명 -
공생미생물총 (마이크로바이옴)이 숙주의 면역 발달에 중추적인 역할을 하고 있다는 사실은 여러 선행 연구를 통해서 알려져 왔다. 하지만, 실제로 공생미생물이 만드는 대사물질이 어떤 분자 기전을 통해서 작용하는지에 대해서는 알려진 바가 거의 없었다.
특히 미생물들의 종 다양성 및 유전적 다양성으로 인해 대사물질의 작은 구조적 차이에 의해 일어나는 생리활성의 차이에 대한 연구는 큰 어려움이 있었다. 그렇기 때문에 막연하게 장내 마이크로바이옴에 의존해 왔었다로 볼 수 있다.
서울대학교(총장 오세정)는 자연과학대학 화학부 박승범 교수 연구팀과 Harvard Medical School의 Dennis Kasper 교수, Sungwhan F. Oh 교수, 그리고 호주 Monash 대학의 Jamie Rossjohn 교수의 국제공동연구팀이 마이크로바이옴에 대한 다학제적 접근 (화학, 면역학, 미생물학, 구조생물학)을 통해서 대다수 인간의 장에서 발견되는 공생미생물 종인 Bacteroides fragilis (B. fragilis)가 만들어내는 면역조절인자인 BfaGC의 작용 기전을 분석하였다.
“당신이 무엇을 먹었는지 말해달라. 그러면 당신이 어떤 사람인지 알려주겠다. (Dis-moi ce que tu manges, je te dirai ce que tu es)” 1825년 프랑스 미식가 브리아 사바랭이 〈미식예찬〉에서 쓴 유명한 문장이다. 결론적으로 본 연구는 인간이 섭취하는 영양소에 의해 장내 공생미생물이 만들어내는 대사체의 구조가 결정되고, 그로 인해 인간 면역계가 조절되는 숙주-공생미생물총-영양소간의 상호작용을 분자 수준에서 규명한 결과라고 설명할 수 있다.
B. fragilis에서 기반한 대사체들의 유기 전합성, 대사체학적 분석을 통해 BfaGC의 세부 구조를 분자수준에서 규명하고, 이러한 구조상의 다양성을 조절하는 인자가 숙주가 섭취하는 영양소 중에서 필수 아미노산의 한 부류인 가지사슬 아미노산 (branched chain amino acid)에 의해서 조절된다는 것을 밝혔다. 즉, 숙주에서 가지사슬 아미노산의 결핍이 발생하거나, 장내 세균의 가지사슬 아미노산의 대사를 차단할 경우, 생리활성을 가지는 BfaGC 분자가 감소하는 것을 관찰하였고, 이로 인해 발달 과정에서 숙주의 면역세포인 자연 살해 T세포가 이상증식하게 되는 것을 보였다.
이렇게 영양소에서 유래한 가지사슬 아미노산에 의해 공생세균에서 만들어지는 BfaGC들은 지금까지 알려져 있었던 자연 살해 T세포의 염증반응을 유발하는 분자들과 비슷한 구조로 CD1d 단백질에 결합하지만, 염증반응이 아닌 면역조절을 유도함으로써 공생세균이 과도한 염증으로부터 숙주를 보호하는 복합적인 기전을 제시하였다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 리더연구지원 사업과 바이오의료기술개발사업 (유전자동의보감)의 지원으로 수행되었으며 국제학술지 NATURE에 11월 10일(현지시각) 게재되었다.
[연구결과]
| 논문명 | Host immunomodulatory lipids created by symbionts from dietary amino acids |
|---|---|
| 저널명 | Nature |
| 키워드 | symbiont (공생 미생물), B. fragilis α-galactosylceramide (BfaGC), branched amino acid (가지 사슬 아미노산), natural killer T cell (자연 살해 T 세포), immune regulation (면역 조절) |
| DOI | https://doi.org/10.1038/s41586-021-04083-0 |
| 저자 | Sungwhan F. Oh 교수(공동 제1저자 및 교신저자/Harvard Medical School), T. Praveena 박사(공동 제1저자/Monash 대학교), 송희범 박사(제2저자/서울대학교), 유지선 박사(공동저자/Brigham and Women 병원), 정다정 박사(공동저자/Brigham and Women 병원), Deniz Erturk-Hasdemir 박사(공동저자/Harvard Medical School), 황윤수 연구생(공동저자/서울대학교), ChangWon C. Lee 연구원(공동저자/Harvard Medical School), Jerome Le Nours 박사(공동저자/Monash 대학교), 김현수 박사(공동저자/서울대학교), 이제상 박사과정생(공동저자/서울대학교), Richard S. Blumberg 교수(공동저자/Brigham and Women 병원), Jamie Rossjohn 교수(교신저자/Monash 대학교), 박승범 교수(교신저자/서울대학교), Dennis L. Kasper 교수(교신저자/Harvard Medical School) |
- ○우리 몸에는 우리 몸의 전체 세포 수보다 더 많은 수의 공생미생물들이 존재하고 있어 우리 몸의 전반적인 기능에 막대한 영향을 끼치고 있다. 이러한 중요성으로 인하여 제 2의 인간게놈프로젝트라고도 불리는 인간 미생물군집 프로젝트가 진행되었고 우리 몸 안에 있는 공생미생물의 종류와 비율 등의 개략적인 정보가 수집되었다.
- ○공생미생물들이 우리 몸의 면역 체계 조절에도 많은 영향을 미치고 있다는 사실이 밝혀지기 시작하면서 그 중요성이 더욱 커지고 있다.
- ○공생미생물 B. fragilis가 만들어내는 α–galactosylceramide (BfaGC)가 면역 조절 인자라는 사실은 어느 정도 밝혀졌으나 이에 대한 정확한 구조는 밝혀내지 못했다. 이는 공생미생물이 만들어내는 물질은 순수한 단일 물질로 분리할 수 없다는 근본적인 한계로부터 기인한다. 이를 극복하기 위해서는 대한 다학제적 (화학, 면역학, 미생물학, 구조생물학) 접근 방식을 통한 연구가 필요했다.
- ○동족체들의 대사체 혼합물로 이루어져 있는 BfaGC를 구조적으로 규명하기 위하여 지방 사슬의 길이, 가지 등의 구조가 다양한 BfaGC 유도체들을 디자인하였다. 디자인한 유도체들은 역합성 분석을 통해 전합성 하였고, 이를 통해 23개의 유도체들을 성공적으로 확보하였다. 합성한 BfaGC와 추출한 BfaGC는 질량 분석 실험에서 동일한 결과를 보임으로서 정확한 구조를 확인하였다.
- ○쥐에게 먹이는 영양소 중에서 가지 사슬 아미노산을 많이 먹이다가 먹이지 않았을 때, 가지 구조가 많은 BfaGC의 비율이 증가하였다 감소하는 결과를 확인하였다. 즉 영양소(음식)를 통한 가지사슬 아미노산의 섭취가 BfaGC의 가지화에 영향을 미친다는 것을 알 수 있었다. 이를 검증하기 위해 가지 사슬 아미노산의 대사에 중요한 유전자를 제거한 B. fragilis는 상대적으로 가지 구조를 지니는 BfaGC를 덜 만들어내었고, 이는 숙주의 장내 자연 살해 T 세포의 수의 증가로 이어졌다. 이를 통해 가지 구조를 지니는 BfaGC가 장내 자연 살해 T 세포의 수를 조절하는데 있어 필수적인 것을 확인하였다.
- ○합성한 BfaGC에 의한 자연 살해 T 세포의 IL-2 분비를 살펴본 결과 스핑가닌에 가지 구조를 지닌 유도체들이 더 많은 IL-2 분비를 일으켰고 BfaGC의 가지 구조 중 스핑가닌의 구조가 더 중요하다는 것을 밝혔다. 한편, 스핑가닌에 가지 구조를 지니는 BfaGC SB2217은 기존 aGC들이 분비를 일으키는 IFN-γ, IL-4의 분비를 매우 약하게 일으켰다.
- ○SB2217이 나타내는 독특한 생리활성을 바탕으로 자연 살해 T 세포에 의한 장염에 걸린 쥐에게 SB2217을 처리한 결과 SB2217이 염증으로부터 쥐를 보호한다는 것을 밝혔다. 아울러 BfaGC 대사체 중의 하나인 SB2217은 독특한 자연 살해 T 세포 신호 전달 체계를 유발한다는 것을 밝혔다.
- ○T 세포 수용체-CD1d 단백질-SB2217이 이루는 삼중 복합체의 결정 구조를 획득하였다. 이를 통해 SB2217이 기존의 aGC와 비슷한 구조로 CD1d 단백질에 결합하지만 구조적으로 기존의 aGC들과 다른 차이를 바탕으로 BfaGC의 작용 기전을 설명하였다.
- ○장내 면역 체계를 조절하는데 중요한 역할을 하는 공생미생물인 B. fragilis의 대사체인 BfaGC의 합성에 있어 가지 사슬 아미노산의 섭취가 중요한 역할을 한다는 것을 밝혔다. 아울러 면역 조절 작용에 있어 BfaGC 대사체 중에 유효 물질인 SB2217을 유기합성으로 확보 및 발굴하고 작용 기전을 밝혔다.
- ○이번 연구결과는 공생미생물에서 유래된 대체체인 SB2217을 자연 살해 T 세포에 의한 장염에 의한 염증을 완화하는 치료제 개발에 활용할 수 있을 것으로 기대한다. 더 나아가 자연 살해 T 세포에 의한 과다한 염증 반응을 완화하는 공생미생물 대사체가 자가면역질환 치료제 개발의 초석이 될 것으로 기대된다.
- ○따라서 마이크로바이옴이 아닌 이의 생리 활성 대사체를 통해서 호스트와의 상호작용을 조절하고, 이 활성 대사체의 생체내 양은 공급되는 영양소에 따라 결정됨을 확인하였으며, 이를 통해 면역 시스템을 조절할 수 있음을 새롭게 밝혀내었었다. 또한 이러한 결과들을 바탕으로 대사체 중의 하나인 SB2217을 기반으로 하여 더 효과가 좋은 새로운 생리 활성 유도체들을 발굴할 수 있을 것으로 기대된다.
[그림설명]
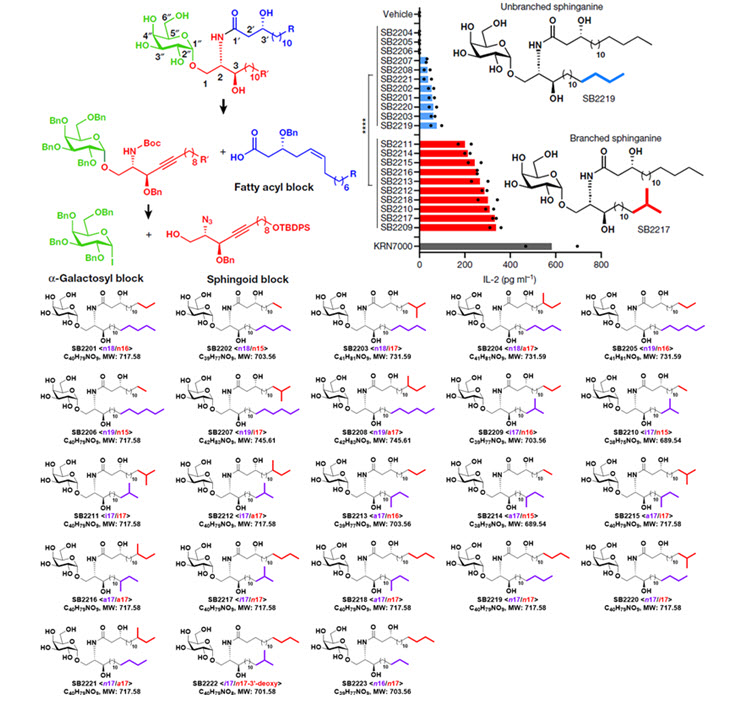
(그림) 공생미생물 Bacteroides fragilis가 만들어내는 BfaGC 역합성 분석과 이를 바탕으로 전합성한 23개의 BfaGC 유도체들. 스핑가닌 가지 구조가 면역 조절에 있어 중요한 역할을 함.
장내 공생미생물에 의한 스핑고지질들의 구조적 다양성을 고려하여 다양한 길이 및 아이소메틸, 안테아이소메틸 가지 구조를 포함하는 BfaGC 유도체들을 체계적으로 디자인하였다. 디자인한 유도체들은 역합성 분석을 바탕으로 전합성하여 BfaGC 유도체 23개를 성공적으로 확보하였다. 이를 통해 스핑가닌의 가지 유무에 따라 면역 반응을 조절하고, 그 중 SB2217은 독특한 자연 살해 T 세포 신호 유발한다는 것을 밝혔다.

(그림) 생체(호스트, 숙주), 공생미생물, 그리고 음식과의 상관관계를 보이는 그림. 다양한 마이크로바이옴 (공생미생물)들은 호스트와의 상호작용에서 자신이 생성하는 대사체를 활용하게 되며, 그 대사체는 호스트가 섭취하는 음식에 의해서 조절이 됨을 분자수준에서 이해한 연구임.

