-질병과 관련된 바이오마커 및 치료 표적 발굴 등 기대-
서울대학교(총장 오세정)는 KAIST(총장 이광형) 의과학대학원 서재명 교수 및 서울대학교 화학부 이현우 교수, 서울대학교 생명과학부 김종서 교수 연구팀의 공동 연구로 생체 내 조직 특이적 분비 단백질 표지 기법을 개발했다.
서울대-KAIST 공동 연구팀은 근접 표지 효소를 활용해 생쥐 혈장 내에서 특정 조직이 분비하는 단백질만을 분리할 수 있는 기법을 개발했다. 이러한 체내 표지 기법은 지금까지의 체외 세포주 실험의 한계를 뛰어넘어 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
김광은 연구원(KAIST 의과학대학원), 박이삭 연구원(서울대 화학부)이 공동 제1저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 9월1일(수)자 온라인판에 출판됐다.
(논문명: Dynamic tracking and identification of tissue-specific secretory proteins in the circulation of live mice).
분비 단백질은 세포 및 조직 간의 신호 전달을 매개하여 생리학적 기능을 조절하는 주요한 인자이며 질병 치료제의 주요 표적으로도 활용되고 있기 때문에 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다.
현재까지 대부분의 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다.
이를 극복하기 위해서는 체내 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다.
공동 연구팀은 문제 해결을 위해 근접 표지 효소를 활용해 소포체 내강을 통하는 분비 단백질을 바이오틴으로 표지했다. 표지된 단백질은 스트렙타비딘을 이용해 손쉽게 검출하거나 분리할 수 있었다.
이 효소를 생쥐의 간에 전달한 후 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있음을 확인했다.
나아가 공동 연구팀은 이 기법을 질병 모델에서 검증하기 위해 인슐린 저항성 생쥐 모델에 적용하였고, 그 결과 인슐린 저항성과 관련이 있는 것으로 보고 된 단백질들을 성공적으로 검출할 수 있었다.
공동 연구팀은 추후 이 기법을 체내의 다양한 조직에 적용하거나 질환 모델과 결합하여 질병의 진행 과정과 관련된 단백질을 검출할 수 있을 것으로 예상했다.
공동 제1저자인 김광은 연구원은“체내에서 간이 분비하는 단백질들은 세포주의 결과와는 크게 달랐다. 이는 기존 세포주를 이용한 분비 단백질 연구의 한계와 그 한계를 극복할 수 있는 본 기법의 차별성을 보여주는 결과이다”라며 “체내 생리학적 상태를 더 온전하게 반영할 수 있는 바이오마커 및 치료 표적 발굴에 활용될 수 있을 것”이라고 말했다.
이번 연구는 한국연구재단, KAIST 중점연구소(융합연구단), 기초과학연구원의 지원을 받아 수행됐다.
[연구결과]
1. 연구 배경
분비 단백질은 체내에서 다양한 생리학적, 병태생리학적 과정을 매개하며 특히 내분비 단백질은 혈액으로 분비되어 조직과 조직 간의 신호를 전달한다. 또한, 분비 단백질은 질병 치료제의 주요 표적이 될 수 있어 분비 단백질 연구는 생물학적, 의학적으로 중요한 의미가 있다. 기존의 전형적인 분비 단백질 연구는 세포주 배양 수준에서 배양 상층액을 분석하는 것이지만, 체외 세포 배양은 체내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다. 이를 극복하기 위해서는 체내에서 특정 조직이 혈액으로 분비하는 단백질을 연구해야 한다. 그러나, 체내의 혈액에는 수천 종의 단백질이 혼합되어 있어 특정 조직이 분비하는 단백질만을 분리하는 기법이 요구되는 상황이다. 따라서, 본 연구에서는 근접 표지 효소를 활용하여 살아있는 동물 내에서 특정 조직이 분비하는 단백질을 규명할 수 있는 기법을 개발하고자 하였다.
2. 연구 내용
근접 표지 효소인 TurboID는 근접한 단백질에 바이오틴을 표지할 수 있고, 표지된 단백질은 스트렙타비딘(Streptavidin)을 이용해 손쉽게 분리할 수 있다. 본 연구팀은 이 효소를 분비 단백질의 분비 경로에 있는 소포체 내강에 위치시켰을 때, 분비 단백질을 효과적으로 표지 할 수 있음을 확인했다. 이후, 생쥐 체내에 적용하기 위해 아데노바이러스를 제작하여 간의 소포체 내강에 표지 효소를 발현시켰다. 이 생쥐에 바이오틴을 투여한 결과, 생쥐의 혈장에서 간 유래 분비 단백질만을 검출할 수 있었다. 생체 내 간 유래 분비 단백질은 세포 배양을 통한 간 세포주의 분비 단백질과는 확연한 차이가 있었다. 나아가, 본 연구팀은 분비 단백질 표지 기법이 질환 모델에 적용될 수 있는지 확인해 보았다. 대조군 생쥐와 인슐린 저항성이 유도된 실험군 생쥐에서 간이 분비하는 단백질을 비교해 보았을 때, 인슐린 저항성과 관련이 있는 것으로 보고 된 단백질들을 검출할 수 있었다. 즉, 본 기법이 질환 모델에서도 성공적으로 적용될 수 있음을 검증했다.
3. 기대 효과
본 연구팀은 근접 표지 효소를 이용해 특정 조직에서 분비된 단백질을 혈장에서 분리 및 검출할 수 있는 기법을 개발하였다. 본 연구는 간에 적용하였지만, 각종 바이러스 벡터(Viral vector)와 형질 전환 마우스를 이용하면 간뿐만 아니라 체내의 다양한 세포와 조직에 적용할 수 있다. 즉, 조직 간 신호 전달을 매개하는 내분비 단백질들에 관한 연구에 도움이 될 수 있다. 또한, 조직별로 각각의 질환 모델을 결합하면 병태생리학적 과정과 관련된 단백질을 검출할 수 있을 것으로 예상한다. 궁극적으로, 이 기법을 통해 인간의 질병과 관련된 바이오마커(Biomarker) 및 치료 표적 물질을 발굴할 수 있을 것으로 기대한다.
[그림설명]
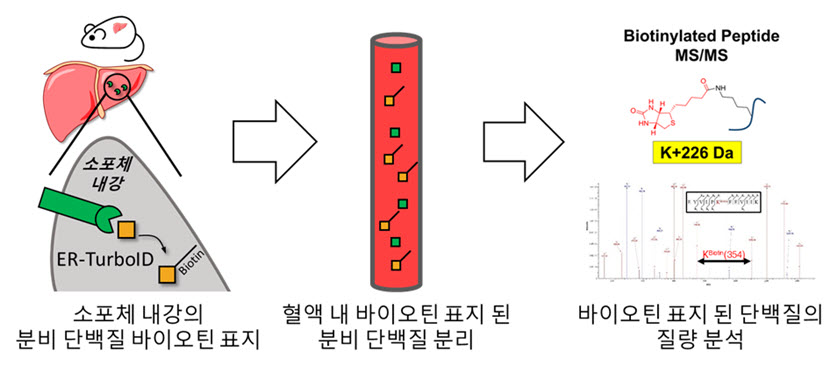
그림 1. 생체 내 조직 특이적 분비 단백질 표지 기법의 모식도
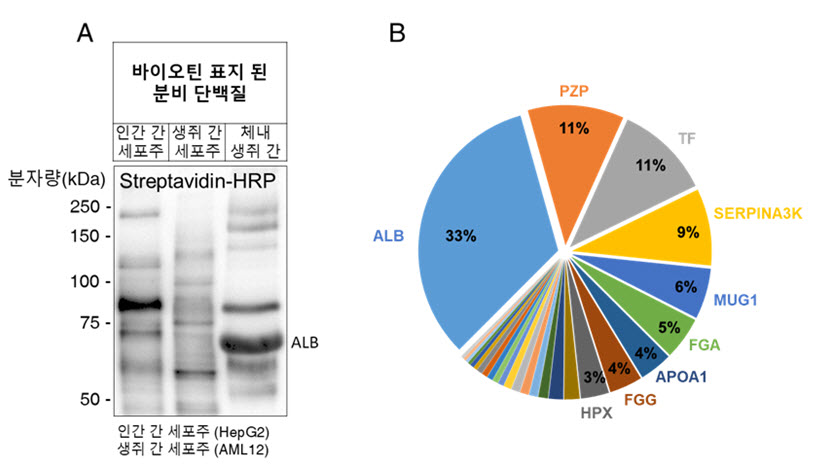
그림 2. (A) 간 세포주와 체내 간 조직의 분비 단백질 차이. (B) 본 기법으로 검출된 체내 생쥐 간 조직의 분비 단백질.

