- 아밀로이드 베타와 타우 병증을 매개하는 분자 규명 -
서울대학교(총장 오세정)는 묵인희 교수(의과대학 생화학교실, 국가 치매극복연구개발사업단 단장) 연구팀이 알츠하이머병 독성인자인 아밀로이드 베타와 타우 단백질의 상호작용을 매개하는 분자를 규명하고 이를 통한 알츠하이머병 진행 완화 가능성을 제시했다고 밝혔다.
이번 연구는 보건복지부(장관 권덕철)와 과학기술정보통신부(장관 임혜숙)가 공동으로 추진하는 치매극복연구개발사업과 과학기술정보통신부가 추진하는 선도연구센터사업의 지원으로 수행되었으며 뇌과학 분야 국제학술지 ‘Progress in Neurobiology’에 5월 15일 온라인판으로 게재되었다.
알츠하이머병은 전체 치매 발병 원인의 약 70%를 차지하고 있는 대표적인 퇴행성 뇌질환으로 임상적으로 기억과 인지기능 장애를 동반한다. 알츠하이머병 환자의 뇌 조직 내에는 아밀로이드 베타와 타우 단백질의 독성 응집체가 축적되고 신경염증반응과 신경세포 사멸이 동반된다는 사실이 밝혀져 있다.
알츠하이머성 치매 쥐 모델에서 아밀로이드 베타가 존재할 때 타우의 병리적인 과인산화와 응집이 가속된다. 반면 타우를 없앤 치매 쥐 모델에서는 아밀로이드 베타가 존재하더라도 일반 치매 쥐에 비해 신경세포 사멸과 인지기능 저하가 현저히 감소해 아밀로이드 베타가 타우 병증을 통해 신경독성을 유발한다는 ‘아밀로이드 베타-타우 축’(Aβ-Tau axis)의 개념이 제시되었다.
연구팀은 알츠하이머성 치매 모델에서 Plexin-A4 단백질이 아밀로이드 베타로 인해 유도되는 타우 병증을 연결하는 중요분자임을 밝히고 이 단백질을 조절해 아밀로이드 베타 병증의 변화 없이도 타우 병증을 감소시켜 알츠하이머병의 진행을 억제할 수 있음을 확인하였다.
Plexin-A4 단백질이 보조 단백질 NRP-2와 함께 아밀로이드 베타와 결합하는 수용체로서 기능할 수 있음과 Plexin-A4 단백질 발현을 억제하면 아밀로이드 베타에 의해 유도되는 타우의 과인산화와 병리적인 응집이 거의 일어나지 않음을 확인하였다. 아밀로이드 베타와 타우를 모두 가지는 알츠하이머병 치매 모델 쥐의 뇌에서 Plexin-A4 단백질의 발현을 억제하면 동일 연령의 치매 쥐에 비해 인지기능 저하가 회복되고 병리적으로 과인산화된 타우가 현저히 감소되었다.
묵인희 교수는 “알츠하이머성 치매의 중요한 원인 인자들인 아밀로이드 베타와 타우 축의 매개인자를 규명하고 그 경로를 조절하여 병의 진행을 억제할 수 있음을 보여준 연구”라고 설명하며, “이러한 기초연구 결과들이 치료제 개발의 타겟 연구로 활용되고 산업화까지 이어지는 선순환체계가 만들어지기를 희망한다”고 기대를 표명하였다.
[연구결과]

- ○알츠하이머병(Alzheimer’s Disease)은 치매의 가장 큰 원인질환으로 점진적인 기억, 인지기능의 장애가 나타나는 퇴행성 뇌질환이다. 65세 이상 노인 인구의 10% 이상이 치매를 앓고 있는 것으로 조사되며, 특히 다른 중증질환들과는 달리 치매 환자의 발생은 지속적으로 증가 추세를 보이고 있어 체계적이고 적극적인 대응이 요구되는 상황이다.
- ○비정상적인 아밀로이드 베타(Amyloid-beta, Aβ)의 축적, 과인산화된 타우(Tau) 단백질 응집의 축적과 신경세포 및 시냅스의 소실이 알츠하이머병을 구분짓는 생물학적 마커이다.
- ○특히 베타 아밀로이드에 의해 유도되는 타우의 과인산화와 비정상적인 응집이 알츠하이머병의 진행과 악화에 있어 중요한 요인이라는 사실이 여러 실험으로 밝혀지며 ‘아밀로이드 베타-타우 축’ (Aβ-Tau axis)의 개념이 정립되었지만 구체적인 기전과 매개요소에 대해선 이견이 있었다.
- ○연구팀은 아밀로이드 베타와 타우 병증을 매개하는 기전을 찾고 이를 통해 알츠하이머병의 진행을 억제할 수 있는 인자를 규명하고자 했다. 그리고 연구를 통해 Plexin-A4라는 세포막 수용체 단백질이 신경세포 외부의 아밀로이드 베타와 결합해 타우 단백질의 과인산화와 응집을 유도하는 매개분자임을 밝히고 이를 억제해 알츠하이머 치매 쥐에서 질환의 진행을 늦출 수 있음을 보였다.
- ○알츠하이머병 환자의 뇌에서 발견되는 아밀로이드 신경반을 구성하는 아밀로이드 베타와 신경섬유매듭을 구성하는 과인산화된 타우는 알츠하이머병의 주요 독성 단백질들이다.
- ○아밀로이드 베타와 타우 단백질이 함께 축적되는 알츠하이머성 치매 쥐와 동일 연령대의 타우 단백질만이 축적되는 치매 쥐를 비교하면 두 단백질을 모두 가지는 치매 쥐에게서 현저히 빠른 타우 병증의 악화와 기억과 인지기능의 이상, 그리고 신경세포 사멸이 나타난다. 이는 아밀로이드 베타의 존재로 인해 타우의 과인산화와 비정상적인 응집이 촉진된다는 사실을 보여준다.
- ○이때 아밀로이드 베타와 타우가 함께 있는 알츠하이머성 치매 쥐의 뇌에 Plexin-A4의 발현을 억제시키면 타우 단백질의 과인산화와 축적이 감소되고 인지기능의 저하가 정상적으로 회복됨을 확인하였다. 특히 아밀로이드 베타 병증의 개선 없이 타우 병증의 감소만으로도 이러한 변화가 나타났다.
- ○신경세포에서도 Plexin-A4의 발현을 억제하면 아밀로이드 베타가 주어졌을 때 유도되던 타우의 과인산화가 일어나지 않았으며, 세포가 살아있는 상태에서 타우 단백질 응집을 관찰할 수 있는 Tau-BiFC 기법으로 분석한 결과에서도 Plexin-A4 발현이 억제되면 아밀로이드 베타로 유도되던 타우 응집이 방지되었다.
- ○Plexin-A4는 세포막 단백질로 본래 발달과정에서의 신경축삭 성장방향을 결정하는데 중요한 수용체로 밝혀져 있다. 아밀로이드 베타로 면역침강법을 수행하면 같은 종류의 단백질 중 오직 Plexin-A4와 보조 수용체인 NRP-2만이 함께 검출되며, 알츠하이머 치매 쥐의 뇌에서 Plexin-A4는 아밀로이드 베타로 구성된 신경반 주변에서 NRP-2와 함께 밝게 관찰된다. 또한, Plexin-A4와 NRP-2 두 단백질 모두를 발현시킨 세포에만 아밀로이드 베타가 붙는다는 점에서 Plexin-A4가 NRP-2와 함께 아밀로이드 베타에 대한 수용체로 기능함을 규명하였다.
- ○알츠하이머병은 뇌 조직의 독성 단백질들의 축적과 이로 인한 만성적인 신경염증이 결국 점진적인 신경세포의 사멸을 일으키는 퇴행성 뇌질환이다. 이 중 아밀로이드 베타를 대상으로 많은 치료제들의 임상연구가 진행되었지만 아직까지 고무적인 결과가 나오지 않았다. 이에 보다 직접적으로 신경독성과 연관성을 가지는 타우 병증을 완화하거나 억제하는 접근법이 시도되고 있으며 아밀로이드 베타와 타우 모두를 대상으로 삼는 치료제 개발도 일부 이루어지고 있는 상황이다.
- ○알츠하이머병의 진행과정에서는 아밀로이드 베타의 축적이 타우의 축적보다 이른 시기에 일어난다. 이번 연구결과는 Plexin-A4 라는 매개체를 통해 아밀로이드 베타가 타우의 과인산화와 응집을 유도하고 있음을 보이고 이 과정을 억제하여 알츠하이머성 치매의 진행을 완화시키고 인지기능 저하를 개선시킬 수 있음을 시사한다.
[용어설명]
- ○대표적인 치매의 원인 질환으로 전체 치매환자의 60% 이상이 여기에 속한다. 아밀로이드 베타와 타우 단백질의 독성 응집체가 뇌에 축적되어가며 신경염증과 신경세포 사멸을 동반한다. 만성적인 퇴행성 뇌질환으로 점진적으로 뇌 부위가 손상되어가며 기억과 인지기능의 감퇴를 불러온다.
- ○알츠하이머병 환자 뇌에 비정상적으로 축적되어 독성을 나타내는 단백질이며 이들이 뭉친 특징적인 구조인 신경반(Neuritic Plaque)이 관찰된다.
- ○정상적인 상황에서 신경세포의 세포골격을 안정화시키는 단백질이나 각종 퇴행성 신경질환에서는 비정상적으로 과인산화(hyper-phosphorylation)되고 응집된 신경섬유매듭(Neurofibrillary tangles) 상태의 타우가 관찰된다. 타우 병증은 아밀로이드 병증보다 직접적으로 신경퇴행과 연관성을 가진다.
- ○아밀로이드 베타가 병리적인 타우 과인산화와 응집을 유도해 타우 병증의 악화로 직접적인 신경독성과 인지기능 저하가 유도된다는 개념
- ○신경세포 막단백질의 한 종류로 기존에는 발생단계에서 신경 축삭의 경로조절기능이 밝혀져 있던 인자이다.
[그림설명]
아밀로이드 베타-타우 축의 새로운 매개체 발견
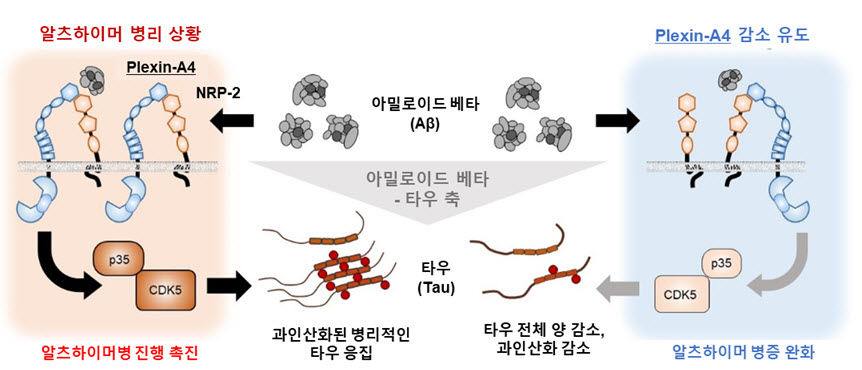
알츠하이머병에서는 아밀로이드 베타가 타우 단백질을 과인산화시켜 응집을 촉진하고 독성을 띄도록 변성시키는데, Plexin-A4 단백질이 해당 독성 신호를 전달하는 주요 매개체임을 확인하였다. Plexin-A4는 NRP-2의 도움을 받아 아밀로이드 베타와 결합하며, 타우 인산화 효소인 CDK5-p35를 통해 타우의 과인산화와 변성을 유도한다. 이는 아밀로이드 베타-타우 축(Aβ-Tau axis)의 존재를 증명하는 결과라 할 수 있다.

