- DNA 메틸화에 의한 지방세포 크기 제어기전 규명 -
비만은 당뇨, 지방간, 심혈관질환, 암 등 다양한 대사질환의 주요 위험인자로서 우리나라의 비만 유병률은 2016년 기준 34.8%에 달하며, 이로 인한 사회경제적 손실은 연간 11.5조원에 이른다. 지방조직의 불균형적 증가로 인한 비만은 지방세포의 크기 증가와 교체율 변화를 동반하는 리모델링과정을 거치게 되며, 이는 지방조직의 기능 이상 및 신진대사 질환을 유발한다.
서울대학교 자연과학대학 생명과학부 김재범 교수 연구진은 비만 시 관찰되는 거대 지방세포의 형성을 억제하는 새로운 제어기전을 규명함으로써 거대 지방세포의 축적에 의한 인슐린 저항성과 같은 대사질환을 제어할 수 있는 새로운 가능성을 제안하였다.
김 교수 연구진은 DNA 메틸화를 매개하는 DNMT1 유전자가 지방세포에서 염색체 구조 조절을 통하여 거대 지방세포의 형성을 억제하고, 전신적 에너지대사의 항상성을 매개함을 최초로 규명하였다. DNMT1 유전자에 결함이 있는 생쥐는 정상 생쥐와 달리 거대 지방세포 생성이 촉진되며, 고지방식이 섭취를 통해 비만을 유도한 경우 체지방 증가가 가속화되고 인슐린 저항성 등 대사질환 지표가 악화되었다.
상기 연구결과는 비만 및 대사질환 치료법 개발에 있어 DNMT1 유전자가 새로운 표적이 될 수 있음을 시사한다.
이번 연구성과는 세계적 학술지인 미국 국립과학원회보인 “PNAS” 온라인 판에 게재승인되었다. 또한, 본 연구결과의 학문적 우수성을 인정받아 “PNAS”의 Commentary 섹션에 해당 연구결과가 별도로 소개될 예정이다. 본 연구는 과학기술정보통신부의 리더연구사업의 지원을 받아 수행되었다.
※ 논문명: DNMT1 maintains metabolic fitness of adipocytes through acting as an epigenetic safeguard of mitochondrial dynamics.
※ 주저자: 김재범 교수(교신저자, 서울대), 박윤정 연구원(제1저자, 서울대)
□ 연구 결과의 의의
본 연구성과는 1) 비만 및 대사질환을 억제하는 염색체 구조 조절 기전을 규명했다는 점, 2) 지방세포 내 DNA 메틸화와 염색체 구조 조절의 연결고리를 최초로 밝혔다는 점, 그리고 3) 이러한 연구결과를 바탕으로 항비만 기전을 새롭게 제시하고 나아가 비만 극복 및 치료법 개발에도 중요한 학문적 토대를 제공한다는 것에 의의가 있다.
[연구결과]
DNMT1 maintains metabolic fitness of adipocytes through acting as an epigenetic safeguard of mitochondrial dynamics
Yoon Jeong Park, Sangseon Lee, Sangsoo Lim, Hahn Nahmgoong, Yul Ji, Jin Young Huh, Assim A. Alfadda, Sun Kim, and Jae Bum Kim
(PNAS, March, 2021; 118 (11) e2021073118)
지방조직은 전신적 에너지대사의 항상성을 조절하는 핵심조직이다. 최근 연구결과에 의하면, 비만 및 대사질환에서 관찰되는 지방조직의 기능이상은 염색체 구조 이상을 동반할 것이라고 제안되었다. 그러나, 정상과 비만 동물의 지방세포에서 염색체 구조를 제어하는 기전에 대한 연구는 시도된 바 없다.
DNA methyltransferase 1(DNMT1)은 DNA 메틸화를 조절하는 핵심인자로 유전자 발현 조절에 중요하다. 본 연구진은 DNMT1에 의한 DNA 메틸화 변화가 CTCF 결합 제어를 통해 특정 염색체 구조 유지에 관여하며, 이를 통해 정상적인 지방세포 형성을 매개함을 최초로 밝혔다.
지방세포에서 DNMT1이 결핍된 생쥐의 경우 염색체 구조 변화를 동반한 미토콘드리아 기능 이상이 관찰되었으며, 이는 지방조직 증가와 전신적 당대사 및 지방대사 이상을 유발하였다. 고지방식이 섭취를 통해 비만을 유도한 경우, DNMT1이 결핍된 생쥐는 정상 생쥐에 비해 지방조직이 크게 증가하였을 뿐 아니라 인슐린 저항성이 악화되었다. 상기 결과들은 지방세포의 DNMT1이 에너지대사 항상성에 필요한 염색체 구조를 통제하는데 핵심적 역할을 담당하는 주요인자임을 제안한다.
[용어설명]
- ○지방세포는 잉여 에너지를 지방대사물의 형태로 저장하는 세포이다. 지방세포는 크기와 형태가 역동적으로 변화하며, 그에 따라 기능적 변화도 다양하게 나타난다. 특히, 비만을 동반한 대사질환 환자의 경우 정상인에 비해 비정상적으로 크기가 커진 지방세포의 축적이 관찰되며, 이러한 큰 지방세포는 만성염증을 쉽게 유발함으로써, 당뇨병, 심혈관질환등 여러 대사질환 발병에 깊이 관여한다. 지방세포의 비정상적인 크기 증가를 유발하는 주요 요인 중 하나로 저장한 에너지원을 소비하는 미토콘드리아의 기능손상이 잘 알려져 있다.
- ○DNA 메틸화는 염기서열의 변화없이 유전자의 발현을 조절하는 주요 후생유전학적 조절 과정이다. 비만 환자의 지방세포의 경우, 정상과는 다른 DNA 메틸화 패턴이 발견되었으며, 이러한 메틸화 변화는 유전자를 인코딩 하지 않는 영역에 대부분 존재한다.
- ○생명체의 DNA는 염색체 형태로 보관된다. 지금까지 많은 연구들은 게놈 내 DNA 염기서열 변화가 다양한 생명현상에 미치는 영향을 연구해 왔다. 하지만 최근 들어 염색체 구조가 유전자 발현 조절과 에너지 대사 항상성 유지에 매우 중요함이 제안되고 있다. 최근, 비만 환자의 지방조직에서도 정상인과는 다른 염색체 구조가 형성됨이 보고되었다. 그럼에도 불구하고, 비만에서 관찰되는 염색체 또는 유전체의 3차원 구조 변화를 통제하는 분자적 기전 및 주요 조절인자에 대한 연구는 매우 부족한 상황이다.
[그림설명]
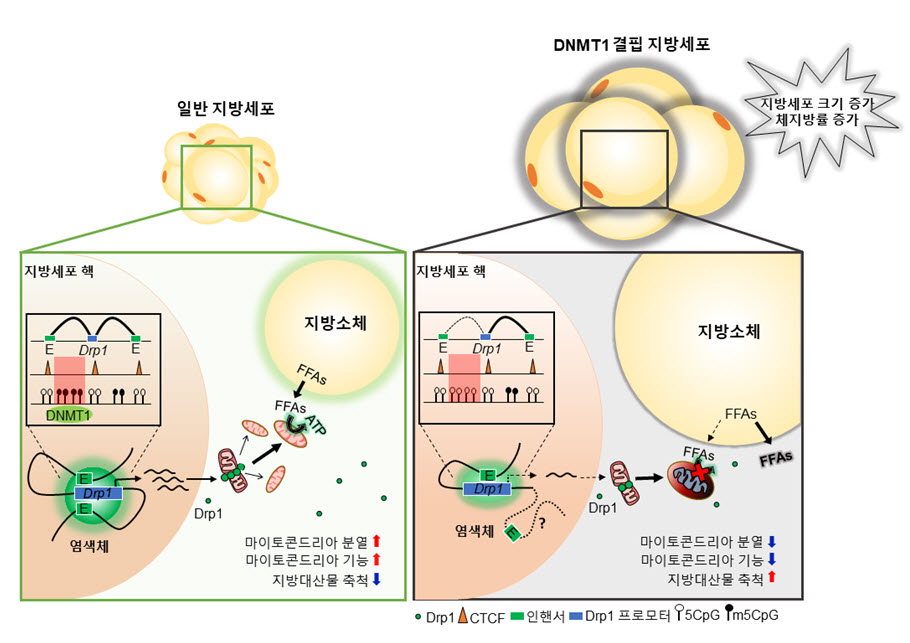
그림. DNMT1에 의한 거대 지방세포 형성 억제 기전
지방세포의 DNMT1 유전자가 결핍된 생쥐는 DNA 메틸화 저하로 인해 정상 지방세포와는 다른 염색체 구조가 형성된다. 이러한 염색체 구조 변화는 지방세포의 미토콘드리아 기능 손상을 유발하며, 이는 지방대사물의 연소억제를 야기함으로써 거대 지방세포 생성을 촉진한다. 고지방식이 섭취를 통해 비만을 유도한 경우, 지방세포의 DNMT1 유전자에 결함이 있는 생쥐는 체지방량 증가가 가속화되어 비만, 당뇨병 등의 대사질환 발병이 심화된다.

