- 세포 노화 타이머를 제어할 수 있는 새로운 방법 발견 -
생명과학부 이준호 교수 연구팀이 아주대 생명과학과 박대찬 교수 연구팀과의 공동 연구로 생쥐 배아줄기세포를 이용하여 포유류 염색체 말단의 텔로미어가 새롭게 재구성되는 구조를 발견했다.
텔로미어는 염색체 말단의 보호 구조를 지칭하며, 세포가 분열할 때마다 중요한 유전 정보를 대신하여 사라지는 보호막 역할을 수행한다. 텔로미어 길이가 일정 수준 이하로 짧아지면 세포는 분열을 멈추는 세포 노화 상태로 들어가고, 이로 인해 텔로미어는 세포 분열의 타이머로도 불린다.
일반적인 체세포는 텔로미어를 유지할 수 있는 기전이 없지만, 활발히 분열하는 생식 세포나 줄기 세포는‘텔로머레이즈’라는 효소를 사용하여 텔로미어 길이를 유지한다. 암세포 또한 대부분 텔로머레이즈를 이용하여 텔로미어 길이를 유지하고 무한한 분열 능력을 가진다.
텔로미어 길이를 적절히 조절하여 분열 수를 조절하면서 세포들이 정상적인 기능을 가지도록 하는 것이 세포 노화 및 개체 전체의 노화과정에서 중요한데, 이 과정이 잘못되면 암이 발생될 수 있다. 따라서 텔로미어 유지 기전에 대한 정확한 이해는 부작용 없이 텔로미어를 조절하여 항암 전략, 노화 지연 등에서의 이로운 효과를 얻을 수 있도록 하는 이론적 기반이 될 수 있다.
일부의 암세포에서는‘대안적인 텔로미어 유지기전(ALT)’이라고 하는, 텔로머레이즈를 사용하지 않고 텔로미어를 유지할 수 있는 시스템이 발견되었다. 따라서 ALT까지 완벽히 이해해야 텔로미어를 정확히 이해할 수 있고 조절할 수 있다.
자연 상에도 ALT를 통해 텔로미어를 유지하며 독특한 텔로미어 서열을 가지는 생물이 존재한다. 그런데 인간 암세포의 경우, ALT를 사용하더라도 일반적인 반복서열로만 텔로미어가 구성된 사례만 보고되어 있어 다른 생물들과는 차이가 있었다.
본 연구에서는 포유류 모델 최초로 일반적인 반복서열이 아닌 다른 구성을 가지는 형태로 텔로미어가 재구성된 사례를 보고했다. 이를 통해 인간 암세포에도 또다른 형태의 텔로미어가 존재할 가능성이 드러났다.
텔로미어 길이가 정상적인 세포, 텔로미어가 짧아져 세포 노화 상태에 있는 세포, ALT가 활성화 된 이후의 세포 등 다양한 시점의 생쥐 배아줄기 세포에 여러 오믹스 기법(유전체, 전사체, 단일세포 전사체, 단백질체 분석)을 적용하여 ALT 세포의 분자적인 특징을 규명했다.
이 연구의 성과는 국제학술지 네이쳐 커뮤니케이션즈(Nature Communications)에 2021년 2월 17일(수) 게재되었다.
[연구결과]
Telomeres reforged with non-telomeric sequences in mouse embryonic stem cells
Chuna Kim*, Sanghyun Sung*, Jong-Seo Kim*, Hyunji Lee, Yoonseok Jung, Sanghee Shin, Eunkyeong Kim, Jenny J. Seo, Jun Kim, Daeun Kim, Hiroyuki Niida, V. Narry Kim, Daechan Park#, Junho Lee#
세포가 분열하며 증식하는 과정은 수정란에서부터 생물이 완성되기까지의 발생 단계를 포함하는 대부분의 생명 현상에서 매우 중요하다. 그런데 우리 몸을 구성하는 세포는 무한히 분열할 수 없으며, 제한된 분열 이후 더 이상 분열하지 못하는 세포 노화 상태로 들어가게 된다. 세포는 분열함에 따라 일정 부분의 DNA가 복제되지 못하고 사라지도록 설계되어 있고, 자신의 유전정보(DNA)를 온전히 지키기 위해 분열 횟수를 제한하게 된다. 그렇다면 세포는 어떻게 자신의 분열 횟수를 기록할까? 세포는 정확한 기록을 위해 텔로미어라는‘타이머’를 지니고 다닌다.
텔로미어(telomere)는 그리스어로 끝을 뜻하는 telos와 부위를 뜻하는 meros의 합성어로써 선형염색체의 끝 부분을 구성하는 동시에 보호하고 있는 구조를 지칭한다. 세포의 잔여 분열 횟수가 감소하는 과정은 시간의 흐름, 즉 노화와 밀접한 관련성이 있는 것으로 여겨져왔고 많은 연구자들은 분열 타이머를 되감을 수 있는 방법을 연구해왔다. 그 중 대표적인 발견은 지속적인 세포 분열이 필요한 일부 세포 (생식 세포, 줄기 세포)에서 작동하는 텔로머레이즈(telomerase)라는 효소이다. 이 효소는 텔로미어 끝 부분에 단백질을 암호화하지 않는 특정 염기서열(포유류의 경우 TTAGGG)을 반복적으로 붙여 DNA 감소를 억제하게 된다. 세포 타이머와 이를 되감을 수 있는 효소의 발견에 2009년 노벨생리의학상이 수여되었다. 그렇다면 이 효소로 타이머를 되감으면 세포가 계속 분열하고 유익하기만 할까? 일찍이 많은 연구자들은 대부분의 암세포(85%)에서 텔로머레이즈 활성이 나타남을 확인하였고, 일반적인 세포에 텔로머레이즈를 과하게 발현시키면 무한한 분열 능력을 가지고 암세포화하게 되는 문제점이 발생할 수 있다. 따라서 부작용없이 유익한 효과를 얻으려면 텔로미어 타이머의 작동 기전을 정확히 이해하고, 이를 제어할 수 있는 기전이 마련되어야 한다.
그렇다면 모든 종은 동일한 세포 타이머 제어 효소를 가지고 있을까? 선형염색체를 가진 진핵 세포에는 필연적으로 염색체 끝이 존재하고, 반드시 이를 보호하기 위한 특별한 기전이 마련되어야 한다. 그런데 흥미롭게도 모든 진핵세포가 텔로미어를 만들기 위해 동일한 서열과 작동방식을 이용하고 있는 것이 아니다. 유전학 연구의 대표적인 모델 생물인 초파리는 레트로트렌스포존(retrotranspson)을 길들여 텔로미어로 활용하고 있으며, 양파와 다양한 곤충 등에서도 텔로머레이즈가 아닌 다른 방식의 타이머 제어 기전이 활용되고 있음이 밝혀졌다. 최근 활발히 진행되고 있는 지구상의 모든 종의 염기서열을 밝히는 Earth genome project가 끝나면 다른 방식으로 텔로미어를 유지하는 종의 수는 훨씬 더 늘어날 것으로 전망된다.
텔로머레이즈 효소를 활용하지 않는 방식으로 세포 타이머를 제어하는 기전을 총칭하여 대안적 텔로미어 유지기전 (Alternative Lengthening of Telomeres, ALT)이라 부른다. 텔로머레이즈를 주로 사용하는 생명체, ALT 기전을 주로 사용하는 생명체가 존재하지만 흥미롭게도 텔로머레이즈를 주로 사용하는 생명체의 텔로머레이즈 유전자를 유전학적인 방법으로 망가뜨리면 ALT 기전으로 자신의 텔로미어 기전을 변환한다. 이러한 변환과정은 대표적인 모델 생물인 효모와 예쁜꼬마선충(본 연구팀의 선행 연구)를 통해 규명된 바 있다. 또한 암 세포 중에서도 텔로머레이즈 활성을 지니고 있지 않은 세포의 경우에는 ALT 기전을 이용해 자신의 텔로미어 타이머를 제어한다.
인간의 텔로미어는 TTAGGG라는 단순한 서열이 수천 번 이상 반복되어 구성된다. ALT를 이용하는 세포의 경우, 텔로미어의 내용물이 일반적인 반복 서열과는 달라질 가능성이 있는데, ALT를 이용하는 인간 암세포의 경우 텔로미어는 텔로머레이즈를 사용하는 세포와 동일하게 TTAGGG의 단순한 반복 서열이다. 오랜 세월 동안 인간이나 쥐 모델에서는 TTAGGG 기반의 텔로미어만이 관찰되었기 때문에 이러한 형태의 텔로미어가 진화적으로 가장 안정된 형태라고 여겨지기도 했다. 그러나 암 세포가 아닌 모델 생물에서 ALT를 작동시킨 경우에는 흥미롭게도 텔로미어를 구성하는 염기 서열이 TTAGGG가 아닌 다른 서열로 대체되는 경우가 많았다.
본 연구는 최초로 포유류에서도 텔로미어가 TTAGGG 단순반복서열이 아닌 다른 서열로 재구성될 수 있음을 보였다. 텔로머레이즈가 불활성화된 생쥐 배아줄기 세포를 계속 배양하다 보면 텔로미어가 점차 짧아지고 분열이 느려지는 시기가 오는데, 아주 일부의 세포에서 ALT가 활성화되어 정상적인 분열 속도를 회복한 것을 관찰했다. 이때의 ALT 세포는 단순반복 서열이 아닌 독특한 서열이 증폭된 구조를 보였다. 생쥐 배아줄기 세포에서 발견된 이 새로운 서열을 ALT 텔로미어에서의 주형이라는 의미에서 mTALT (mouse template for ALT)라고 명명했으며, 특정한 염색체의 텔로미어 바로 안쪽에 위치하고 있었다.
ALT 암세포의 경우 직접적인 대조군으로 사용할 만한 ALT가 활성되기 전의 정상적인 세포와 비교하는데 어려움이 있어, ALT가 실제로 작동하는 과정을 추적하는데 한계가 있었다. 본 연구팀은 텔로미어 결손 과정, 세포 노화, ALT 활성, ALT 안정화 과정을 시간 순으로 프로파일링하기 위해 최신의 다양한 오믹스 기법(유전체, 전사체, 단일세포 전사체, 단백질체 분석)을 활용하였으며, 이 과정은 서울대학교 김종서 교수팀 및 아주대학교 박대찬 교수 팀과의 협업으로 진행되었다. 핵심적인 발견으로 HMGN1이라는 단백질이 ALT 세포의 안정적인 텔로미어 유지를 위해 기능하기 있음을 밝혔다. HMGN1은 ALT 텔로미어에 결합하여 텔로미어의 3차원적인 구조를 느슨하게 하고 텔로미어로부터 RNA가 생산되도록 유도했다. 텔로미어에서 생산된 RNA는 자신의 주형인 텔로미어 DNA와 상호작용함으로써 RNA-DNA 루프(R-loop)를 형성하는데, 이 루프는 텔로미어의 안정적인 유지를 위한 신호가 되어 주었다. 본 연구는 선형염색체의 끝 부분을 보호할 수 있는 기전이 텔로미어 반복 서열과 텔로머레이즈 효소라는 단순 공식이 아닐 수 있음을 규명하였으며, 이를 통해 텔로미어라는 개념을 끝을 보호할 수 있는 다양한 기전으로 확장 정의하는데 새롭게 기여하였다. 또한 우리 DNA에 내재된 특정 서열이 끝을 보호할 수 있는 잠재력을 가지고 있음을 새롭게 확인하였다. 그렇다면 특정 염기서열인 mTALT 서열이 어떻게 텔로미어의 구성원으로 선택될 수 있었는지, mTALT 기반의 텔로미어의 정확한 구성은 어떠한지 이해하는 것이 흥미로운 다음 과제다. 본 연구의 결과는 포유류 텔로미어에서 새로운 구조가 진화할 수 있음을 분자적인 수준에서 밝혀, 앞으로의 텔로미어 기전 연구 및 노화, 암 생물학 연구에 중요한 밑거름이 되어줄 것이다.
[용어설명]
- ○선형 염색체 말단을 구성하고 있는 핵산-단백질 복합체를 지칭하며, 일반적으로 단순한 반복 서열로 이루어져 있다. 세포 분열마다 일부의 DNA가 소실되는데 텔로미어는 유전 정보를 대신하여 소실되는 보호 역할을 수행한다. 텔로미어 길이가 일정 수준 이상으로 짧아지면 세포가 더 이상 분열하지 않는 세포 노화 상태에 들어간다. 많은 경우 텔로머레이즈라고 하는 효소에 의해 단순반복서열이 보충되어 세포의 분열 능력을 유지한다.
- ○텔로머레이즈를 사용하지 않고 텔로미어 길이를 유지하는 기전을 통칭하여 이르는 용어이다. 기본적으로 상동재조합(homologous recombination)에 기반한 기전으로 텔로미어 길이를 늘려준다고 알려져 있으며, 약 15% 정도의 인간 암세포에서 발견된다.
- ○RNA 분자가 DNA와 상보적인 결합을 통해 상호작용하여 이루고 있는 3가닥의 핵산 구조를 말한다. DNA 복제 기구나 전사 기구가 DNA를 읽는 과정에서 방해가 되기 때문에 유전체의 불안정성을 유도하는 것으로 알려졌다. 특정한 조건에서는 RNA-DNA 루프가 DNA의 복구 기전을 활성화시켜 유전체의 유지에 도움을 주기도 한다.
[그림설명]
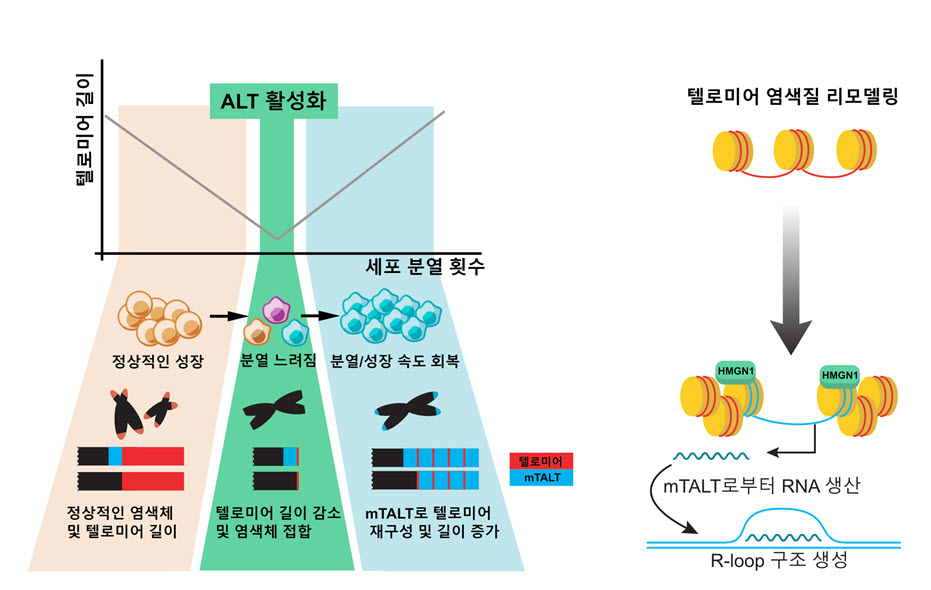
세포가 분열하면 텔로미어 길이가 짧아지며 점차 분열할 수 없는 상태에 가까워진다. 텔로미어 길이를 유지할 수 있는 텔로머레이즈 효소가 없는 생쥐 배아줄기 세포를 배양하면 마찬가지 현상이 관찰된다. 대부분의 세포는 분열을 멈추고 죽어 나간다. 하지만 그 중 아주 일부의 세포는 ALT 기전을 활성화하고 텔로미어 길이 및 성장 속도의 회복이 일어난다. 이 때 텔로미어 서열은 단순한 반복 서열(빨간색)이 아닌 새로운 서열(파란색, mTALT) 위주로 재구성된다. ALT 세포에서는 HMGN1 단백질이 텔로미어에 결합하여 RNA를 생산하고 R-loop 구조를 형성하여 텔로미어 유지에 도움을 준다.

